
| A. | V正(X2)═2V逆(XY) | |
| B. | 单位时间内生成2n mol XY的同时,生n mol的Y2 | |
| C. | 容器内气体密度不随时间而变化 | |
| D. | X2、Y、XY的浓度之比为2:2:1 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、反应达到平衡状态时,2V正(X2)═V逆(XY),故A错误;
B、单位时间内生成2n mol XY,等效于消耗2n mol XY,同时生成n mol的Y2,正逆反应速率相等,说明达平衡状态,故B正确;
C、两边气体计量数相等,恒温恒压下,体积是一个定值,质量守恒,所以容器内气体密度始终不随时间而变化,故C错误;
D、当体系达平衡状态时,X2、Y、XY的物质的量之比可能为2:2:1,也可能不是2:2:1,与各物质的初始浓度及转化率有关,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
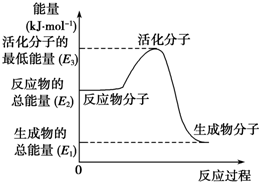 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是| A. | 上述图示的反应为吸热反应 | |
| B. | 图中的能量变化如图所示,则△H=E1-E3 | |
| C. | H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 | |
| D. | 根据①②推知:在25℃、101 kPa时,1 mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于676.7 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 所有非金属之间形成的化学键一定是共价键 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 化学变化一定有化学键的断裂和形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g/mol | B. | 56g/mol | C. | 84g | D. | 112 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,1mol Mg与足量盐酸反应失去电子数为2NA | |
| B. | 标准状况下,11.2L H2O所含的分子数为0.5NA | |
| C. | 0.1molCH4所含的电子数为NA | |
| D. | 通常状况下,NA 个CO2分子占有的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
; +O2$→_{△}^{Cu}$OHCCHO+2H2O;
+O2$→_{△}^{Cu}$OHCCHO+2H2O;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com