

 )发生缩聚反应产物的结构简式为
)发生缩聚反应产物的结构简式为 ;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为
;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为 .
.
 ;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为
;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为 .
. 分析 (1)书写M的分子式,依据CxHyO耗氧量=x+$\frac{y}{4}$-$\frac{z}{2}$计算;
(2)有机物N中含有碳碳三键、苯环、醇羟基、羧基,结合原子团的特征性质分析判断发生的化学反应类型;
(3)M有多种同分异构体,其中能使FeCl3溶液显紫色,说明含有酚羟基,苯环上只有两个取代基、无环物质,另一个取代基为-(CO)-C≡CH,邻间对三种同分异构体,也可以是-C≡C-CHO,也存在邻间对三种同分异构体;
(4)羧基和醇羟基之间发生缩聚反应,通过酯化反应缩去水形成高分子化合物,;
(5)P物质的钠盐在适当条件下氧化为芳香醛Q和银氨溶液发生氧化反应,出现银镜现象,依据醛基被氧化的反应原理书写化学方程式;
(5)有机物Ⅱ是加成聚合物的单体,去掉中括号单键变双键得到,A、B可以发生类似①的反应生成有机物Ⅰ,依据有机物Ⅱ是有机物Ⅰ失水得到,所以有机物Ⅱ中的碳碳双键是醇羟基消去水反应生成,因此有机物Ⅰ是丙炔和正丁醇发生反应生成;
解答 解:(1)书写M的分子式为C9H6O2,依据CxHyO耗氧量=x+$\frac{y}{4}$-$\frac{z}{2}$计算,1molM耗氧量=9+$\frac{6}{4}$-$\frac{2}{2}$=9.5mol,
故答案为:9.5;
(2)有机物N中含有碳碳三键、苯环、醇羟基、羧基,结合原子团的特征性质分析判断发生的化学反应类型
A.碳碳三键、醇羟基可以发生氧化反应,故A不符合;
B.醇羟基、苯环上的氢原子可以发生取代反应,故B不符合;
C.醇羟基相邻碳原子上无氢原子不能发生消去反应,故C符合;
D.碳碳三键、苯环可以和氢气发生加成反应属于还原反应,故D不符合;
E.碳碳三键、苯环可以和氢气发生加成反应,故E不符合;
故答案为:C;
(3)M有多种同分异构体,其中能使FeCl3溶液显紫色,说明含有酚羟基,苯环上只有两个取代基、无环物质,另一个取代基为-(CO)-C≡CH,邻间对三种同分异构体,也可以是-C≡C-CHO,也存在邻间对三种同分异构体,同分异构体有6种,
故答案为:6;
(4)羧基和醇羟基之间发生缩聚反应,通过酯化反应缩去水形成高分子化合物, ,
,
P物质 的钠盐在适当条件下氧化为芳香醛Q和银氨溶液发生氧化反应,出现银镜现象,依据醛基被氧化的反应原理书写化学方程式,
的钠盐在适当条件下氧化为芳香醛Q和银氨溶液发生氧化反应,出现银镜现象,依据醛基被氧化的反应原理书写化学方程式, ,
,
故答案为: ,
, ;
;
(5)有机物Ⅱ是加成聚合物的单体,去掉中括号单键变双键得到结构简式为: ,A、B可以发生类似①的反应生成有机物Ⅰ,依据有机物Ⅱ是有机物Ⅰ失水得到,所以有机物Ⅱ中的碳碳双键是醇羟基消去水反应生成,因此有机物Ⅰ是丙炔和正丁醇发生反应生成,该反应的化学方程式为:
,A、B可以发生类似①的反应生成有机物Ⅰ,依据有机物Ⅱ是有机物Ⅰ失水得到,所以有机物Ⅱ中的碳碳双键是醇羟基消去水反应生成,因此有机物Ⅰ是丙炔和正丁醇发生反应生成,该反应的化学方程式为: ,
,
故答案为: ,
, ;
;
点评 本题考查了有机物性质、官能团结构,化学反应类型的分析判断,注意高聚物形成的反应实质,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
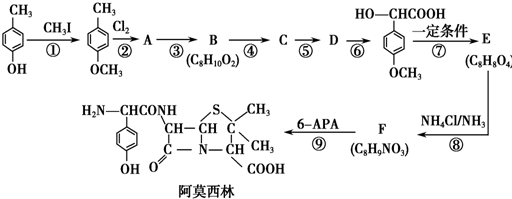
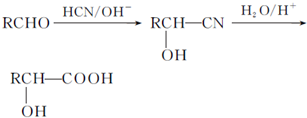

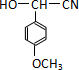 .
.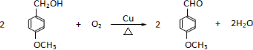 .
.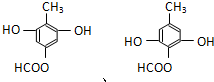 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeO、FeS、CuO、CuS、稀硫酸 | |
| B. | 苯、四氯化碳、无水乙醇、己烯 溴水 | |
| C. | 甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液 | |
| D. | 苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应条件下,碳酸氢钠难溶于水 | B. | 氨气和二氧化碳均来自合成氨工厂 | ||
| C. | 侯氏制碱法实现了对氨气循环利用 | D. | 生产时,应先通二氧化碳再通氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列关于DDT的说法中正确的是:( )
,下列关于DDT的说法中正确的是:( )| A. | DDT分子中两苯环不可能共平面 | |
| B. | DDT分子属于芳香烃 | |
| C. | 若使原苯环上的两个氯原子连接在同一个苯环上,共有6种同分异构体 | |
| D. | DDT难以降解的原因是DDT难以发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com