
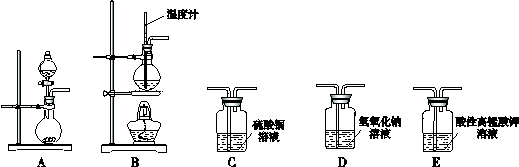
| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | B→D→E | |
| (2) | 乙炔 |
| 浓H2SO4 |
| 170℃ |
| 浓H2SO4 |
| 170℃ |


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
| ||

| 实验方案 | 预期现象 | |
| a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
| b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
| c | 加酸性KMnO4溶液 | 紫色褪去 |
| d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
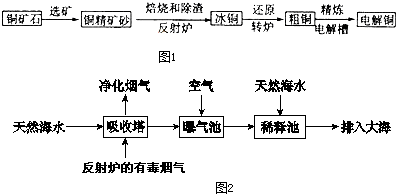
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含H2CO3的溶液:H2CO3═2H++CO32- |
| B、极少量Fe(OH)3溶于水:Fe(OH)3?Fe3++3OH- |
| C、醋酸溶液:CH3COOH??H++CH3COO- |
| D、NaHSO4溶于水:NaHSO4═Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
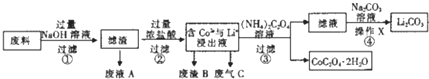
| 编号 | 温度/℃ | 时间/min | 盐酸浓度/mol?L-1 | 钴浸出率/% |
| 1 | 80 | 120 | 3.04 | 97.82 |
| 2 | 80 | 150 | 3.04 | 100.0 |
| 3 | 80 | 180 | 3.04 | 100.0 |
| 4 | 80 | 150 | 2.28 | 100.0 |
| 5 | 80 | 150 | 1.52 | 80.26 |
| 6 | 70 | 150 | 2.28 | 86.85 |
| 7 | 90 | 150 | 2.28 | 100.0 |
| 8 | 80 | 150 | 2.28 | 100.6 |
| 温度/℃ | 0 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2CO3、Ba(NO3)2、KOH、HNO3 |
| B、Ba(NO3)2、KOH、HNO3、K2CO3 |
| C、KOH、K2CO3、Ba(NO3)2、HNO3 |
| D、Ba(NO3)2、KOH、K2CO3、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀盐酸产生气体,将气体通入澄清石灰水,溶液变浑浊,可能有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加硝酸银溶液产生白色沉淀,一定有Cl- |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| (1) |
| 一定条件 |
| (2) |
| 一定条件 |
| (3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com