
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是___________、___________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒___________(填“能”或“否”),其
原因是 。
(3)他们记录的实验数据如下:

已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表ΔH=_____________。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果__________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____________(填“有”或“无”)影响。
【答案】(1)量筒 温度计
(2)否 金属易导热,热量散失多,导致误差偏大
(3)①-56.8 kJ·mol-1②NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-56.8 kJ·mol-1
(4)无 有
【解析】
试题分析:(1)测定中和热小于用量筒量取酸碱溶液的体积,需要用温度计测量温度,实验尚缺少的玻璃用品是量筒、温度计;(2)金属的导热系数大于玻璃,造成热量散失,误差大,所以不能用金属搅拌器;多次测量,温度取平均值23.4℃,m(HCl) = m(NaOH) = 50g,50 mL0.55 mol·L-1NaOH与50mL.0.5mol·L-1HCl发生中和反应时放出的热量为:Q = Cm(t2 -t1)= 4.18 KJ·℃-1· Kg-1 × 0.1kg × (23.4-20) ℃ = 1.42 KJ,生成1mol水时的反应热为:△H=-1.42 KJ ÷ 0.025 mol = -56.8 KJ/mol。NaOH溶液与HCl溶液反应的热化学方程式:NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l) ΔH = -56.8 kJ·mol-1。中和热是指在稀溶液中,酸跟碱发生中和反应生成1 mol液态水时所释放的热量,KOH与NaOH同为强碱,故对测定结果无影响;醋酸为弱电解质,溶于水发生电离,放出的热量较小。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】某一元弱酸(用HA表示)在水中的电离方程式是:HA![]() H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向___________(填“正”、“逆”)反应方向移动。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向___________(填“正向”、“逆向”、或“不移动”)移动,溶液pH将___________中(填“增大”、“减小”或“不变”),溶液中![]() 比值___________(填“增大”、“减小”或“不变”).
比值___________(填“增大”、“减小”或“不变”).
(3)在25℃下,将a molL-1的氨水与0.01molL-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液呈中性,用含a的代数式表示NH3H2O的电离常数Kb=___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:

试回答下列问题:
(1)上述反应平衡常数的表达式为_____________,正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_________(填“增大”“减小”或“不变”),容器内混合气体的压强______________(填“增大”“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有______________(选填字母)。
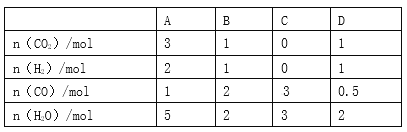
(4)830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪80年代后,人们发现和证实了一种新的含碳物质,它们是由一系列偶数个碳原子组成的分子,其中C60最具代表性。图中所示为n个C60连接而成的物质X 。下列有关说法不正确的是( )

A. X难溶于水,可以与氧气反应生成CO2
B. 该物质是一种新型的化合物
C. X是碳的一种同素异形体
D. X的摩尔质量为720ng·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)0.2molO3和0.3molO2的质量___________(选填“相等”、“不相等”或“无法判断”),分子数之比为__________,所含原子数之比为___________,在相同条件下的体积之比为_____________。
(2)73gHCl气体中含有_____________个分子,标准状况下占有的体积为_____________L。
(3)相同物质的量浓度的KCl、MgCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl的沉淀的质量之比为3:2:1时,三种溶液的体积比为__________。
(4)标准状况下VL氯化氢气体溶解在1L水中,所得溶液的密度为ρgmL,溶液中溶质的质量分数为ω,物质的量浓度为cmolL-1,则ω=__________(任写一种表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为钠硫高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS![]() Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
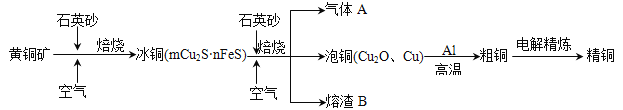
(1)气体A中的大气污染物可选用下列试剂中的 吸收。(双选))
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a. 电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+ 2H2SO4 ![]() 2 CuSO4 + 2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
2 CuSO4 + 2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
酸 | 碱 | 盐 | |
A | H2SO4 | NaOH | BaCO3 |
B | H2S | K2CO3 | CuSO4 |
C | NaHSO4 | NaOH | CaCl2 |
D | HNO3 | KOH | Na2O |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积不变(1 L)的密闭容器中,加入3 mol PCl3和4 mol Cl2使之发生反应PCl3(g)+Cl2(g) ![]() PCl5(g),平衡时容器内压强为开始时的
PCl5(g),平衡时容器内压强为开始时的![]() 。
。
计算并回答:
(1)平衡时,容器内气体密度是开始时的___________倍,气体平均相对分子质量是开始时的_________倍。
(2)保持同一反应温度,若将起始物改为a mol PCl3,b mol Cl2,c mol PCl5。欲使平衡时PCl5的体积分数为![]() ,则a,b,c满足的关系为 , 。欲使开始时反应向逆方向进行,则a的取值范围为 , b的取值范围为 ,c的取值范围为
,则a,b,c满足的关系为 , 。欲使开始时反应向逆方向进行,则a的取值范围为 , b的取值范围为 ,c的取值范围为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com