
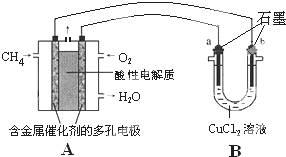
 (3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.
(3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.分析 (1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,1个乙分子中含有18个电子,则乙分子中含有1个C原子、1个O原子,则含有H原子数目为18-6-8=4,故乙为CH3OH,分子中均有氧,故甲为CO;
①发生反应CO (g)+2H2(g)?CH3OH(g),应达到平衡后,测得c(甲)=0.2mol/L,则平衡时n(甲)=2L×0.2mol/L=0.4mol,据此根据三段式计算平衡时各组分物质的量;
②提高甲的转化率,应改变条件使平衡向正反应移动.计算T1温度时平衡常数,与T2温度的平衡常数相比判断该反应的反应热,判断温度对反应的影响,注意不能只增大甲的浓度;
(2)根据盖斯定律书写甲烷不完全燃烧生成一氧化碳和液态水时的热化学方程式;
(3)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+;
②B为电解池,铜离子发生还原反应,在阴极析出,该极连接原电池的负极,根据转移电子计算生成Cu的物质的量,再根据m=nM计算生成Cu的质量.
解答 解:(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,1个乙分子中含有18个电子,则乙分子中含有1个C原子、1个O原子,则含有H原子数目为18-6-8=4,故乙为CH3OH,分子中均有氧,故甲为CO,
故答案为:CO、CH3OH;
①发生反应CO (g)+2H2(g)?CH3OH(g),应达到平衡后,测得c(甲)=0.2mol/L,则平衡时n(甲)=2L×0.2mol/L=0.4mol,则:CO (g)+2H2(g)?CH3OH(g),
开始(mol):2 6 0
变化(mol):1.6 3.2 1.6
平衡(mol):0.4 2.8 1.6
CH3OH在平衡混合物中的物质的量分数为=$\frac{1.6mol}{0.4mol+2.8mol+1.6mol}$=$\frac{1}{3}$
故答案为:$\frac{1}{3}$;
②该反应为放热反应,
A.加入2mol甲,平衡向正反应移动,但甲的转化率降低,故A错误;
B.充入氮气,反应混合物各组分的浓度不变,平衡不移动,甲的转化率不变,故B错误;
C.分离出乙,平衡向正反应移动,甲的转化率增大,故C正确;
D.T1温度时平衡常数为$\frac{\frac{1.6}{2}}{\frac{0.4}{2}×(\frac{2.8}{2})^{2}}$=$\frac{100}{49}$>1,故升高温度平衡向逆反应移动,甲的转化率降低,故D错误;
故答案为:C;
(2)已知:①、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1;
②、2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1,
利用盖斯定律,①×2-②可得:2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H=-1214.6kJ•mol -1
故甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的$\frac{1214.6kJ}{890.3kJ×2}$=0.7,
故答案为:0.7;
(3)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+,
故答案为:CH4-8e-+2H2O=CO2+8H+;
②B为电解池,铜离子发生还原反应,在阴极析出,该极连接原电池的负极,故在b电极析出Cu,b电极的质量增重,转移0.1mol电子,析出铜的物质的量为$\frac{0.1mol}{2}$=0.05mol,故析出铜的质量为0.05mol×64g/mol=3.2g,
故答案为:b;3.2.
点评 本题考查较为综合,为高考常见题型,题目涉及物质推断、化学平衡有关计算、化学平衡常数、电化学以及盖斯定律的应用等,题目难度中等,注意体会盖斯定律的应用,(3)中可以利用总反应式减正极反应式书写负极反应式.


科目:高中化学 来源: 题型:选择题
| A. | 大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H
(1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
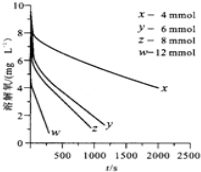
| 反应阶段 | 速率方程 | $\frac{k(297.0K)}{k(291.5K)}$ |
| 富氧区 | v=kc(SO32-)•c(O2) | 1.47 |
| 贫氧区 | v=kca(SO32-)•cb(O2) | 2.59 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
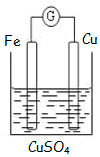 如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 三种酸的电离常数关系:KHA>KHB>KHD | |
| B. | 滴定至P点时,溶液中:c(Na+)>c(B-)>c(HB)>c(H+)>c(OH-) | |
| C. | pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 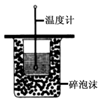 进行中和热的测定 | |
| B. | 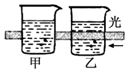 运用该实验可区分胶体和溶液 | |
| C. | 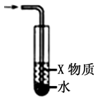 X若为苯,可用于吸收NH3或HCl,并防止倒吸 | |
| D. |  验证AgCl溶解度大于Ag2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com