
【题目】下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3COOHB.Cl2
C.NH4HCO3D.NH3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】请填写以下空白:
(1)有以下物质: ①NaHSO4晶体 ②SO3 ③液态硫酸 ④铁 ⑤BaSO4固体 ⑥饱和 FeCl3溶液 ⑦
酒精(C2H5OH) ⑧熔融的 K2SO4,其中能导电的是__________,属于电解质的是_________,属于非电解质的是______________
(2) 化学反应 FeS+ H2SO4(浓)![]() Fe2(SO4)3+ SO2↑+ S↓+ H2O(未配平)中:
Fe2(SO4)3+ SO2↑+ S↓+ H2O(未配平)中:
氧化产物是:_______, 还原产物是:_______。
(3) 请写出醋酸与氢氧化钠溶液反应的离子方程式_______。
(4) 盐酸可以除铁锈, 请写出发生反应的离子方程式_______。
(5) 工业上常用 H2O2在酸性条件下氧化污水中的 Fe2+,请写出离子方程式:_______。
(6)某液态化合物 X2Y4常用作火箭燃料。 32 g X2Y4在一定量的 O2中恰好完全燃烧,反应方程式为: X2Y4(l)+O2(g) ![]() X2(g)+2Y2O(l)。冷却后在标准状况下测得生成物的体积为 22.4 L,其密度为 1.25 g·L-1。 X2的摩尔质量为_____________, X2Y4化学式为________________。(注: l—液态, g—气态)
X2(g)+2Y2O(l)。冷却后在标准状况下测得生成物的体积为 22.4 L,其密度为 1.25 g·L-1。 X2的摩尔质量为_____________, X2Y4化学式为________________。(注: l—液态, g—气态)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所涉及的物质均为中学化学中的常见物质,其中D为黄绿色气体,E为Fe,除D、E、C外余化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
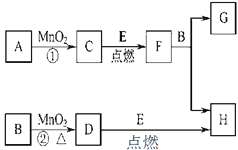
(1)指出MnO2在相关反应中的作用:反应①中是________剂,反应②中是_______剂。
(2)若反应①是在加热条件下进行,则A的化学式是__________;若反应①是在常温条件下进行,则A的化学式是__________。
(3)写出B与MnO2共热获得D的化学方程式_________________________________,该反应中B体现了___________性。
(4)写出F与B反应的离子方程式 ________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
a.配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b.向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c.在55℃~60℃下发生反应,直至反应结束;
d.除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,最后再用蒸馏水洗涤;
e.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯.
请填写下列空白:
①配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是: .
②步骤d中洗涤、分离粗硝基苯应使用的仪器是 .
③步骤d中粗产品用5% NaOH溶液洗涤的目的是 .
④制备硝基苯的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,以石墨为电极电解A的水溶液,并做下面一系列实验.试根据实验现象完成下列问题(电解质A的水溶液焰色反应呈紫色).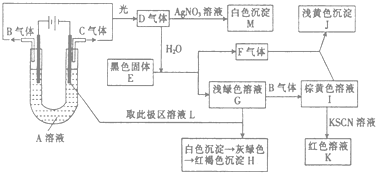
(1)A的化学式为 , E的名称为 .
(2)I和F反应的离子方程式是 .
(3)若将电解装置中的阳极换成铁棒,则在U型管底部可观察到的现象是 , 阳极的电极反应式为 , 阴极的电极反应式为 , 电解的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖获得者施罗克等人发现,金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为( )
①2MoS2+7O2![]() 2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4C1 ④H2MoO4 MoO3+H2O
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.反应①和⑤都属于置换反应
B.MoO3属于碱性氧化物
C.在反应①中Mo和S均被氧化
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为2:2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com