
【题目】下列气体既可以用浓硫酸干燥,又可以用固体碱石灰干燥的是( )
A.SO2
B.NH3
C.Cl2
D.H2
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】元素周期表中氧元素的数据见如图,说法正确的是( ) 
A.氧元素的质量数是16
B.氧元素的相对原子质量是16.00
C.氧原子2p亚层有一个未成对电子
D.氧原子最外层有6个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是( )
实验 | 现象 | 结论 | |
A. | 向2 mL 0.1 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3受热易分解,生成了遇水显碱性的物质 |
D. | 向某溶液中加入盐酸,将生成的气体通入品红溶液中 | 品红溶液褪色 | 该溶液一定含有SO32- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO ![]() (aq)PbCO3(s)+SO
(aq)PbCO3(s)+SO ![]() (aq).Ksp (PbCO3)=1.5×10﹣13 , Ksp (PbSO4)=1.8×10﹣8某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(aq).Ksp (PbCO3)=1.5×10﹣13 , Ksp (PbSO4)=1.8×10﹣8某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(1)计算上述反应的平衡常数:K= .
(2)加入足量NaHCO3溶液也可实现该转化,写出离子方程式
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3Pb(OH)2],它和PbCO3受热都易分解成PbO.该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,假设一:全部为2PbCO3Pb(OH)2;
假设二:全部为PbCO3;
假设三:2PbCO3Pb(OH)2 和PbCO3的混合物
为验证假设一是否成立,课题组进行如下研究.
实验步骤 | 实验现象和结论 |
取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的洗气瓶. | 无水硫酸铜变蓝色,澄清石灰水变浑浊 |
①你是否同意该同学的结论,并简述理由 .
②如果不同意,请提出改进意见 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是( ) 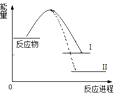
A.1molN≡N键能与3molH﹣H键能之和大于6molN﹣H键能,所以反应为放热
B.N2(g)+3H2(g)2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
C.选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少
D.2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示.下列说法中正确的是( ) 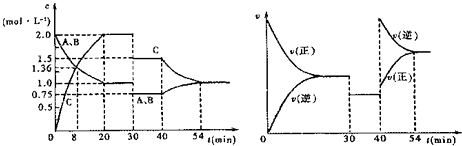
A.反应方程式中的x=1
B.该反应为放热反应
C.30 min时改变的条件是加入催化剂
D.前30 min内A的反应速率为0.05 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 金属氧化物都能和水反应
B. Fe(OH)3 胶体带正电
C. 往 Fe(OH)3 胶体中逐滴滴入硫酸溶液,现象是:先有红褐色沉淀后沉淀溶解
D. Fe(OH)3 胶体能够吸附水中悬浮的固体颗粒沉降,达到消毒目的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com