
| 实验次数 | 镁带质量(g) | 硫酸体积(ml) | C装置中液体的体积(ml) | 最后抽气的体积(ml) | 氢气的体积(ml) | 计算1mol氢气的体积(L) |
| ① | 0.125 | 10 | 128.5 | 3.0 | 121.5 | 23.34 |
| ② | 0.133 | 10 | 135.5 | 3.0 | 128.5 | 23.19 |
| ③ | 0.127 | 10 | 129.7 | 3.0 | 122.7 | 23.19 |
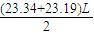 ;
;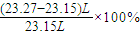 ;
;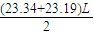 =23.27L(保留2为小数),故答案为:23.27;
=23.27L(保留2为小数),故答案为:23.27;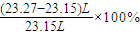 =0.52%,故答案为:0.52;
=0.52%,故答案为:0.52;

科目:高中化学 来源: 题型:
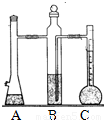
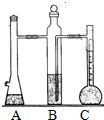 利用如图装置可以测定常温下1mol氢气的体积,某同学的实验数据以及计算结果如下:
利用如图装置可以测定常温下1mol氢气的体积,某同学的实验数据以及计算结果如下:| 实验次数 | 镁带质量(g) | 硫酸体积(ml) | C装置中液体的体积(ml) | 最后抽气的体积(ml) | 氢气的体积(ml) | 计算1mol氢气的体积(L) |
| ① | 0.125 | 10 | 128.5 | 3.0 | 121.5 | 23.34 |
| ② | 0.133 | 10 | 135.5 | 3.0 | 128.5 | 23.19 |
| ③ | 0.127 | 10 | 129.7 | 3.0 | 122.7 | 23.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
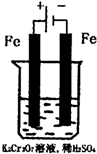 环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO
环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO2- 4 |
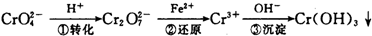
2- 4 |
2- 7 |
2- 3 |
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
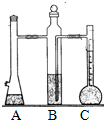 利用如图装置可以测定常温下1mol氢气的体积,某同学的实验数据以及计算结果如下:
利用如图装置可以测定常温下1mol氢气的体积,某同学的实验数据以及计算结果如下:| 实验次数 | 镁带质量(g) | 硫酸体积(ml) | C装置中液体的体积(ml) | 最后抽气的体积(ml) | 氢气的体积(ml) | 计算1mol氢气的体积(L) |
| ① | 0.125 | 10 | 128.5 | 3.0 | 121.5 | 23.34 |
| ② | 0.133 | 10 | 135.5 | 3.0 | 128.5 | 23.19 |
| ③ | 0.127 | 10 | 129.7 | 3.0 | 122.7 | 23.19 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验次数 | 镁带质量(g) | 硫酸体积(ml) | C装置中液体的体积(ml) | 最后抽气的体积(ml) | 氢气的体积(ml) | 计算1mol氢气的体积(L) |
| ① | 0.125 | 10 | 128.5 | 3.0 | 121.5 | 23.34 |
| ② | 0.133 | 10 | 135.5 | 3.0 | 128.5 | 23.19 |
| ③ | 0.127 | 10 | 129.7 | 3.0 | 122.7 | 23.19 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com