
【题目】有一处于平衡状态的反应:X(s)+3Y(g)![]() 2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z (g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
【答案】D
【解析】试题分析:反应X(s)+3Y(g)![]() 2Z(g),△H<0,正反应是气体物质的量减小的放热反应,①升高温度,平衡逆向移动,故①错误;②降低温度,平衡向正反应移动,故②正确;③压强增大,平衡向正反应移动,故③正确;④降低压强,平衡向逆反应方向移动,故④错误;⑤加催化剂缩短到达平衡的时间,不会引起化学平衡的移动,故⑤错误;⑥分离出Z,即减小生成物的浓度,平衡正向移动,故⑥正确;故选C。
2Z(g),△H<0,正反应是气体物质的量减小的放热反应,①升高温度,平衡逆向移动,故①错误;②降低温度,平衡向正反应移动,故②正确;③压强增大,平衡向正反应移动,故③正确;④降低压强,平衡向逆反应方向移动,故④错误;⑤加催化剂缩短到达平衡的时间,不会引起化学平衡的移动,故⑤错误;⑥分离出Z,即减小生成物的浓度,平衡正向移动,故⑥正确;故选C。
【名师点晴】本题考查化学平衡移动的影响因素等。升高温度,平衡向吸热反应移动;降低温度,平衡向放热反应移动;压强增大,平衡向气体体积减小的方向移动;降低压强,平衡向气体体积增大的方向移动;加催化剂不会引起化学平衡的移动;增大反应物浓度或减小生成物的浓度,平衡正向移动;减小反应物浓度或增大生成物浓度,平衡逆向移动。注意加入惰性气体对平衡的影响,恒温恒容平衡不移动,恒温恒压,体积增大,平衡向体积增大方向移动。


科目:高中化学 来源: 题型:
【题目】由﹣C6H5、﹣C6H4﹣、﹣CH2﹣、﹣OH四种原子团(前两者为含苯环的基团)组成属于酚类物质的种类有( )
A.1种
B.2种
C.3种
D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 含金属元素的离子不可能是阴离子
B. 含有不溶性杂质的粗盐提纯过程中,玻璃棒最多使用两次
C. 饱和FeCl3滴入沸水并稍微加热,得到的是带正电的氢氧化铁胶体
D. 非金属单质参与的氧化还原反应中,非金属元素既可能被氧化又可能被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,针对表中的①﹣⑧八种元素,用元素符号或化学式回答相关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | |||||||
三 | ② | ③ | ④ | ⑤ | ⑥ | |||
四 | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼原子的原子结构示意图为 .
(2)用电子式表示①与③形成化合物的过程 .
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是 , ②、④的最高价氧化物对应水化物的溶液反应的离子方程式为: .
(4)①②③④四种元素的简单离子半径由大到小的顺序是 . (用离子符号和“>”表示).
(5)①⑤⑧三种元素的单质沸点由高到低的顺序是 . (用化学式和“>”表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4 +2LiCl+Ca=CaCl2+Li2SO4, 下列说法正确的是

A. 常温时,在正负极间接上电流表,指针不偏转
B. 放电过程中,Li+向负极移动
C. 正极反应式:Ca+2Cl--2e-=CaCl2
D. 每转移0.1mol电子,理论上生成20.7gPb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能相互反应得到氢氧化铝沉淀的是
A. 金属铝和氢氧化钠溶液 B. 硝酸铝溶液和过量氢氧化钠溶液
C. 氧化铝和热水 D. 硫酸铝溶液和过量的氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是
A. 反应进行的方向 B. 反应的快慢 C. 反应进行的限度 D. 反应物的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前 4 周期中的 A、B、C、D、E 五种主族元素.A 的最高价氧化物含 A 质 量分数 40%,A 原子中质子数等于中子数;B 是同周期中除稀有气体外原子半径最大的元 素;D 能形成 BD 型离子化合物,且 B、D 两离子的电子层结构相同;C 和 D 能形成 CD3 的化合物;C 原子比 E 原子多 1 个电子;B、C、D 的最高价氧化物的水化物两两均可反应 生成盐和水;D 原子比 A 原子多 1 个质子.则;
(1)B 原子结构示意图为
(2)用电子式表示 A 和 B 组成的化合物的形成过程
(3)用离子方程式表示 A 和 D 的非金属性强弱
(4)写出 C 的最高价氧化物的水化物分别和 B、D 的最高价氧化物的水化物反应的离子方 程式
(5)DE 形成的化合物中化学键类型为
(6)A2D2分子中每一个原子均达到最外层 8e﹣稳定结构,请写出其电子式和结构式、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偶氮苯是橙红色晶体,溶于乙醇,微溶于水,实验室制取反式偶氮苯的步骤如下:
步骤一:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,装上冷凝管,加入少量镁粉,立即发生反应。等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
步骤二:将所得液体趁热倒入冰水中,并不断搅拌,用冰醋酸小心中和至pH 为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
步骤三:用95%的乙醇重结晶。
(1)步骤一中反应不需要加热就能剧烈进行,原因是____________。镁粉分两次加入的原因是______________。
(2)步骤二中析出固体用冰水洗涤的原因是______________。若要回收甲醇,实验所需的玻璃仪器除冷凝管、酒精灯、牛角管和锥形瓶外还应有___________。
(3)取0.1g偶氦苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1cm处,再将滤纸条末端浸入裝有1: 3 的苯-环己烷溶液的容器中,实验操作及现象如图所示。
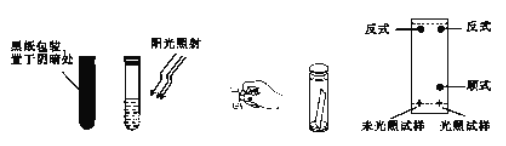
①实验中分离物质所采用的方法是_______法。
②由实验结果可知:_______;利用该方法可以提纯反式偶氮苯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com