
我国工业废水中几种污染物的最高允许排放浓度
污染物 | 汞 | 镉 | 铬 | 铅 | 砷 | 氰化物 |
主要存在形式 | Hg2+ CH3Hg+ | Cd2+ |
| Pb2+ |
| CN- |
最高允许排放浓度/(mg·dm-3) | 0.05 | 0.1 | 0.5 | 1.0 | 0.5 | 0.5 |
注:我国规定酸、碱废水pH的最大允许排放标准是大于6、小于9。
_____________________________________________________________________
科目:高中化学 来源: 题型:阅读理解

| 溴 | 物理性质 | 暗红色液体,刺激性气味.室温下易挥发.熔点-7.2℃,沸点59.1℃.密度2.928g?cm-3.稍溶于冷水. |
| 化学性质 | 溶于水生成次溴酸 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| 微热 |

| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
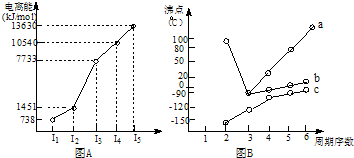
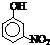
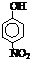
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 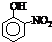 |
 |
 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 试管序号 | 1 | 2 | 3 | 4 | 5 |
| 通入CO2时间/min | 0 | 1 | 5 | ||
| 滴加盐酸/滴 | 0 | 3 | 6 | ||
| 溶液中颜色对比 | 无色 | 浅黄色→黄色(依次加深) | |||
| 滴加淀粉溶液后的颜色对比 | 无色 | 浅蓝色→蓝色(依次加深) | |||
| 实验步骤 | 预期现象和结论 |
| ①取一份纯净的KI固体,分成两等份; | / |
| ②一份加入到装有 一份加入到装有 ③几天后观察. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com