
| A. | 石油裂解主要目的是得到短链的不饱和烃 | |
| B. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| C. | 煤的气化与液化都是化学变化 | |
| D. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 |
分析 A、石油裂解的目的是获得“三烯”;
B、煤中不含苯和甲苯;
C、煤的气化是用煤制取水煤气;煤的液化是用煤制取甲醇;
D、重油的裂化的目的是获得轻质油.
解答 解:A、石油裂解的目的是获得“三烯”,即乙烯等短链不饱和烃,故A正确;
B、煤中不含苯和甲苯,苯和甲苯是通过煤的干馏生成的,故B错误;
C、煤的气化是用煤制取水煤气;煤的液化是用煤制取甲醇,均有新物质生成,故为化学变化,故C正确;
D、重油的裂化的目的是获得轻质油,即汽油、煤油和柴油等,故D正确.
故选B.
点评 本题考查了煤和石油的综合利用,难度不大,应注意的是石油的分馏为物理变化,煤的干馏、煤的气化、煤的液化和石油的裂化、裂解均为化学变化.


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:推断题
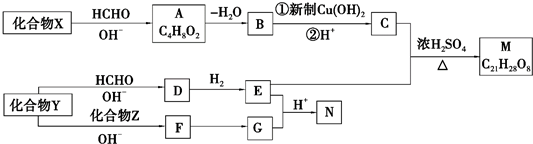
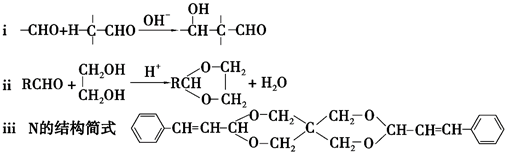
 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O. .
.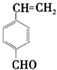 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 问题 | 实验步骤 | 实验现象 | 结论 | |
实验一 | 存在有色离子吗? | 取少量粉末,加水,溶解,过滤 | 有白色沉淀生成,滤液无色 | 这种粉末中一定无FeCl3 |
实验二 | 白色沉淀是什么? | 取少量沉淀,向其中滴加稀盐酸 | 沉淀部分溶解有气泡产生 | 有硫酸钠、碳酸钠、硝酸钡 |
实验三 | 是否含有KCl? | 取少量滤液,滴加硝酸银溶液和稀硝酸 | 产生白色沉淀 | 有KCl存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:推断题

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.6 | 47.5 | 53.8 | 61.3 | 70.5 | 75.4 | 71.1 | 60.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、NO3-、SO42- | B. | Al3+、Na+、SO42-、HCO3- | ||
| C. | Na+、Ca2+、Cl-、SO42- | D. | Fe3+、K+、SCN-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com