
如图装置放置一段时间后,铁钉均被腐蚀。下列有关描述不正确的是( )
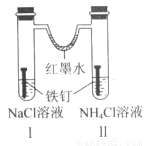
A.红墨水水柱两边的液面变为左低右高
B.I 和Ⅱ中负极反应式均为 Fe-2e-=Fe2+
C.I 中正极反应式为 O2+2H2O+4e-=4OH
D.Ⅱ中 NH4Cl 溶液里有气泡产生
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:实验题
有一种埋在地下的矿物X(仅含四种元素),挖出后在空气中容易发黄,现探究其组成和性质,设计完成如下实验:
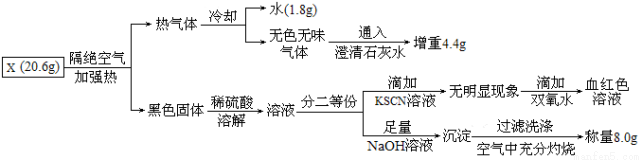
请回答:
(1)X的化学式_________ ________,挖出后在空气中容易发黄的原因______________。
________,挖出后在空气中容易发黄的原因______________。
(2)写出溶液分二等份,加KSCN无明显现象后,滴加双氧水的两个离子方程式:___________________,_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上期末化学卷(解析版) 题型:选择题
某化学兴趣小组进行有关 Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为 NO2
B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4==4CuSO4+2NO↑+4H2O
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu 在常温下既可与稀硝酸反应,也可与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
电解质溶液的电导率越大,导电能力越强。用0.100mol·L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液电导率如图所示。下列说法不正确的是( )
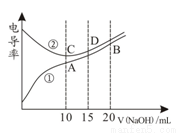
A.曲线①代表滴定CH3COOH溶液的曲线
B.在相同温度下,A、B、C 三点溶液中水电离的 c(H+):B<A=C
C.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
D.A点溶液中:c(CH3COO-)+c(OH-)-c(H+) = 0.05mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
一定条件下,容积为 1L 的密闭容器中发生反应: SiF4(g)+2H2O(g)  SiO2(s)+4HF(g)。下列各项中不能说明该反应已达化学平衡状态的是( )
SiO2(s)+4HF(g)。下列各项中不能说明该反应已达化学平衡状态的是( )
A.v(SiF4)消耗=4v(HF)生成 B.HF 的体积分数不再变化
C.容器内气体压强不再变化 D.容器内气体总质量不再变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:填空题
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:选择题
在恒温、恒容条件下,能使A(g)+B(g) C(g)+D(s) 正反应速率增大的措施是
C(g)+D(s) 正反应速率增大的措施是
A.减小C或D的浓度 B.再加入一定量D
C.减小B的浓度 D.增大A或B的浓度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:推断题
A、B、D、E、Z、G、M七种元素位于元素周期表前四周期,原子序数依次增大。元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物DE2为红棕色气体,Z的单质易与水反应且只作氧化剂,G是前四周期中第一电离能最小的元素,M是第四周期元素,最外层只有一个电子,其余各层电子均充满。
请回答下列问题:
(1)元素B、D、E的第一电离能由大到小的顺序为________(用元素符号表示)。
(2)基态G原子的价电子排布式是 ,M在元素周期表中的位置是 。
(3)元素D和Z组成分子NZ3空间构型为________;该分子为 分子(填极性或非极性),其中D原子的杂化方式为________。
(4)D的最高价氧化物对应的水化物甲与气体DA3化合生成离子化合物乙常温下,若甲、乙两溶液的pH均等于5,则由水电离出的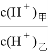 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(5)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构则该化合物的化学式为____________;
②E的氢化物(H2E)在乙醇中的溶解度大于H2Y,其原因是 ;
③X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
气体的体积主要由气体以下哪些因素决定:
①分子的直径 ②分子的相对分子质量
③分子间的平均距离 ④气体的物质的量
A.①② B.②③ C.①③ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com