

| 8 |
| 3 |
| m |
| M |
| 8 |
| 3 |
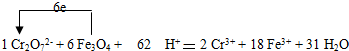
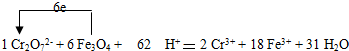 ;
;| 0.1225g |
| 294g/mol |
| 0.1225 |
| 294 |
| 0.1225 |
| 294 |
| 0.1225 |
| 294 |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源:上海市普陀区2013年高考一模化学试题 题型:022
铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强.工业上往往采取下列循环工艺防止铬的污染:

完成下列填空:
1、含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下:
________Cr2O72-+________Fe3O4+________H+→________Cr3++________Fe3++________H2O
配平上述离子反应方程式,并标出反应中电子转移的方向和数目.
2、向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀.写出从该沉淀中分离出Cr(OH)3的离子方程式________、________.
3、回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7.纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
①Cr2O72-+6I-+14H+→3I2+2Cr3++7H2O
②2S2O32-+I2→S4O62-+2I-
准确称取纯净的K2Cr2O70.1225 g,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00 mL.则Na2S2O3溶液的物质的量浓度为________(保留四位有效数字).
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市普陀区高三第一学期期末考试化学试卷(解析版) 题型:填空题
铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强。工业上往往采取下列循环工艺防止铬的污染:

完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下:
Cr2O72- + Fe3O4 + H+ → Cr3+ + Fe3+ + H2O
配平上述离子反应方程式,并标出反应中电子转移的方向和数目。
(2)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。写出从该沉淀中分离出Cr(OH)3的离子方程式 、
。
(3)回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I-
准确称取纯净的K2Cr2O7 0.1225g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为 (保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省深圳市南山区高三上学期期末考试化学试卷(解析版) 题型:填空题
铬及其化合物在现代工业上的应用广泛,可用于电镀,鞣制羊毛,皮革;铬还用于照相材料,胶版印刷及化工触媒剂等。但化工废料铬渣对人体健康有很大危害。
Ⅰ:某工厂对制革工业污泥中Cr(III)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
|
阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
|
开始沉淀时的pH |
1.9 |
7.0 |
—— |
—— |
4.7 |
—— |
|
沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9 (>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施是 (至少答一点)。
(3)调节溶液的pH=8是为了除去 离子。钠离子交换树脂的原理为:
Mn++nNaR→MRn+nNa+,被交换的的杂质离子是 。
(4)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH) 的溶度积Ksp= c(Cr3+)• c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
。
的溶度积Ksp= c(Cr3+)• c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
。
(5)还原过程发生以下反应(请配平): Na2Cr2O7+ SO2+
= Cr(OH) (H2O)5SO4+ Na2SO4;
Ⅱ:工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。
其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe做电极的原因为
在阴极附近溶液pH升高的原因是(用电极反应解释) 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com