
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的( )

A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
【答案】B
【解析】
A、K1闭合构成原电池,铁是活泼的金属,铁棒是负极,铁失去电子,铁棒上发生的反应为Fe+2e-=Fe2+,A不正确;B、K1闭合构成原电池,铁棒是负极,铁失去电子,石墨棒是正极,溶液中的氧气得到电子转化为OH-,电极反应式为O2+4e-+2H2O=40H-,石墨棒周围溶液pH逐渐升高,B正确;C、K2闭合构成电解池,铁棒与电源的负极相连,作阴极,溶液的氢离子放电产生氢气,铁不会被腐蚀,属于外加电流的阴极保护法,C不正确;D、K2闭合构成电解池,铁棒与电源的负极相连,作阴极,溶液中的氢离子放电生成氢气。石墨棒是阳极,溶液中的氯离子放电生成氯气,电极反应式分别为2H++2e-=H2↑、2Cl--2e-=Cl2↑,电路中通过0.002NA个电子时,两极均产生0.001mol气体,共计是0.002mol气体,D不正确,答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物和含碳化合物的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是 ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式 ;
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 ;
(3)SO2是工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.05 |
4 | 0.04 | 0.02 |
6 | 0.02 | |
8 | 0.01 |
①反应在0-4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K= ;
③8min时,维持温度不变,向反应容器中再通入0.02mol SO2(g)和0.01mol O2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”)。
(4)科学家用氮化镓材料与铜组装如下图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应。

写出铜电极表面的电极反应式 ,为提高该人工光合系统的工作效率,可向装置中加入少量 (填“盐酸”或“硫酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 酸化高锰酸钾溶液时可以用盐酸酸化
B. 金属钠着火时不能用泡沫灭火器灭火
C. 氢氧化铁胶体的电泳实验,证明了氢氧化铁胶体带电荷
D. 能与碱反应生成盐和水的氧化物一定是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和煤制品(如水煤气、焦炭、甲醚等)已广泛应用于工农业生产中。
(1)已知:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3 kJ.mol-l
CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.3 kJ.mol-l
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为____________,该反应在_________(填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)利用炭还原法可处理氮氧化物(如NO等),发生的反应为C(s)+2NO(g)![]() N2 (g)+ CO2 (g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得的各气体的浓度如下表所示:
N2 (g)+ CO2 (g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得的各气体的浓度如下表所示:

①10~20 min内,N2的平均反应速率可v(N2)=____________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_______(填字母)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.遁当缩小容器的体积
(3)研究表明,反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示:

若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol.L-l,在该条件下达到平衡时,CO的转化率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关高分子化合物的叙述中正确的是( )
A. 高分子化合物的特点之一是组成元素简单、结构复杂、相对分子质量大
B. 高分子链之间靠分子间作用力结合,因此分子间作用弱,高分子材料强度较小
C. 高分子均为长链状分子
D. 高分子物质均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
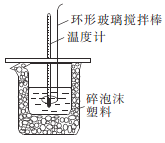
(1)环形玻璃搅拌棒的作用是___________________。
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值________(填“偏大”、“偏小”或“不变”)。
(3)该实验小组做了三次实验,每次取溶液各50 mL,并将实验数据记录如下:

已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4.18×10-3kJ/(g.℃),则该反应的中和热△H=__________。
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值___________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证干燥的氯气无漂白性,湿润的氯气具有漂白性,某同学设计实验如下图。其中B、C、D、E、F分别盛有饱和食盐水、浓硫酸。干燥红色布条、浓硫酸、湿润红色布条。

请回答:
(1)E中浓硫酸的作用____________。
(2)将F中的湿润布条换成卷曲的细铜丝,并用酒精灯加热,可看到的现象是_____________。
(3)若用装置A制取2.24L(标况)氯气,消耗10mol/L浓盐酸的体积明显大于40mL,造成该结果的可能原因有______________。
A.浓盐酸的挥发 B.随反应进行盐酸浓度下降
C.加热时火力不够猛 D.MnO2固体过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com