
酸式盐NaHB在水溶液中,HB—的电离程度小于HB—的水解程度,下列说法正确的是( )
A.HB—水解方程式:HB-+H2O H3O+
+B2-
H3O+
+B2-
B.溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-) >c(H+)
C.NaHB的存在抑制了水的电离
D.相同物质的量浓度溶液的pH值:NaHB > Na2B
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HB-水解方程式:HB-+H2O?H3O++B2- | B、溶液中离子浓度大小为:c(Na+)=c(HB-)>c(OH-)=c(H+) | C、NaHB的存在抑制了水的电离 | D、相同物质的量浓度溶液的pH:Na2B>NaHB |
查看答案和解析>>
科目:高中化学 来源:2013届天津市高二上学期期末考试化学试卷 题型:选择题
已知酸式盐NaHB在水溶液中存在下列反应:①NaHB==Na++HB-②HB-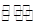 H++B2-③HB-+H2O
H++B2-③HB-+H2O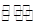 H2B十OH-,且溶液中c(H+)>c(OH-),下列说法中一定正确的是
H2B十OH-,且溶液中c(H+)>c(OH-),下列说法中一定正确的是
A、NaHB为强电解质 B、H2B为强酸
C、H2B为弱电解质 D、HB-的电离程度小于HB-的水解程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com