
解析:本题可分3种情况讨论:(1)氨水电离产生NH![]() 、OH-;(2)NH
、OH-;(2)NH![]() 水解产生H+及剩余NH
水解产生H+及剩余NH![]() ;(3)NH
;(3)NH![]() 水解受到影响,促进或抑制。在分析时要注意两点:氨水电离程度较小,NH
水解受到影响,促进或抑制。在分析时要注意两点:氨水电离程度较小,NH![]() 水解程度也较小。另外,NH4HSO4溶液中,H+抑制NH
水解程度也较小。另外,NH4HSO4溶液中,H+抑制NH![]() 水解,而NH4HCO3中,HCO
水解,而NH4HCO3中,HCO![]() 比氨水更弱,HCO
比氨水更弱,HCO![]() 水解呈碱性,会促进NH
水解呈碱性,会促进NH![]() 水解,(NH4)2SO4溶液中,NH
水解,(NH4)2SO4溶液中,NH![]() 的浓度最大。所以,NH
的浓度最大。所以,NH![]() 的浓度由大到小顺序为(NH4)2SO4、NH4HSO4、NH4Cl、NH4HCO3、NH3·H2O,可根据NH
的浓度由大到小顺序为(NH4)2SO4、NH4HSO4、NH4Cl、NH4HCO3、NH3·H2O,可根据NH![]() 水解程度及电离的情况得出pH由大到小的顺序是NH3·H2O、NH4HCO3、NH4Cl、(NH4)2SO4、NH4HSO4。?
水解程度及电离的情况得出pH由大到小的顺序是NH3·H2O、NH4HCO3、NH4Cl、(NH4)2SO4、NH4HSO4。?
答案:⑤>④>②>③>① ①>③>②>⑤>④


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
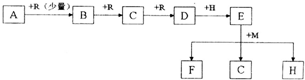
| ||
| ||
| ||
| ||
| 20V |
| 7 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
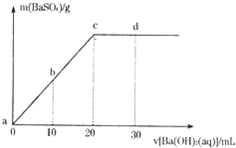 常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )| A、溶液的导电能力:a>b>c>d | B、溶液的pH:a<b<c<d | C、c点溶液和d点溶液均呈碱性 | D、b点溶液中c(H+)和d点溶液中c(OH-)相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com