
分析 (1)碳酸氢钠在水中电离出钠离子和碳酸氢根离子;
(2)NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子.
解答 解:(1)碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-;
(2)NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子,NaHSO4═Na++H++SO42-,
故答案为:NaHSO4═Na++H++SO42-.
点评 本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,碳酸氢钠电离为该题易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
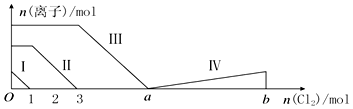
| A. | 线段Ⅱ表示Br-的变化情况 | |
| B. | 线段Ⅳ表示IO3-的变化情况,其中IO3-增加了5moL. | |
| C. | a=6 | |
| D. | 原溶液中n(FeI2):n(FeBr2)=3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
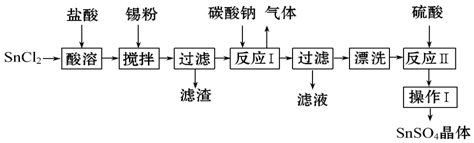
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中的钢闸门连接电源的负极 | B. | 金属护拦表面涂漆 | ||
| C. | 汽水底盘喷涂高分子膜 | D. | 地下钢管连接锌板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 逆反应速率増大,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 逆反应速率减小,正反应速率増大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,活化分子百分数不变,化学反应速率增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率增大 | |
| C. | 使用正催化剂,活化分子百分数增大,化学反应速率增大 | |
| D. | 加入反应物,活化分子百分数增大,化学反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
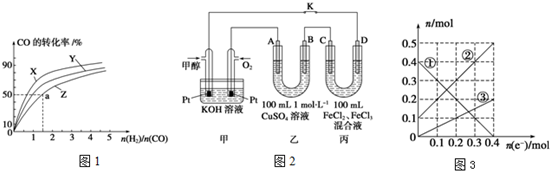
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com