
| A.c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中:c (NH4HSO4) ﹥c(NH4HCO3) ﹥c(NH4Cl) |
| B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:C(Na+)﹥C(CH3COO-)﹥C(H+)﹥C(OH-) |
| C.1.0mol/LNa2CO3溶液中:C(OH-)=C(HCO3-)+C (H+)+2C(H2CO3) |
| D.某二元弱酸的酸式盐NaHA溶液中:C(H+)+C(Na+)=C(OH-)+C(HA-)+C(A2-) |
 NH3·H2O+OH-;由于在NH4HCO3中还存在平衡:HCO3-+H2O
NH3·H2O+OH-;由于在NH4HCO3中还存在平衡:HCO3-+H2O H2CO3-+H+;二者水解的酸碱性可以相互促进,使c(NH4+)减小。在NH4HSO4中电离产生的H+对NH4+水解起抑制作用,使c(NH4+)增大。因此c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中c(NH4HCO3) ﹥c(NH4Cl) ﹥c (NH4HSO4)。错误。B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,所以:C(H+)﹥C(OH-)。根据电荷守恒可得C(Na+)+ C(H+)=C(CH3COO-)+C(OH-)。将1式代入2式可得C(CH3COO-)﹥C(Na+)。盐的大量大于弱电解质的电离,所以C(Na+)﹥C(H+)。因此离子浓度的关系是:C(CH3COO-)﹥C(Na+)﹥C(H+)﹥C(OH-)。错误。C.1.0mol/LNa2CO3溶液中根据质子守恒可得:C(OH-)=C(HCO3-)+C (H+)+2C(H2CO3)。正确。D.某二元弱酸的酸式盐NaHA溶液中,根据电荷守恒可得:C(H+)+C(Na+)=C(OH-)+C(HA-)+2C(A2-)。错误。
H2CO3-+H+;二者水解的酸碱性可以相互促进,使c(NH4+)减小。在NH4HSO4中电离产生的H+对NH4+水解起抑制作用,使c(NH4+)增大。因此c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中c(NH4HCO3) ﹥c(NH4Cl) ﹥c (NH4HSO4)。错误。B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,所以:C(H+)﹥C(OH-)。根据电荷守恒可得C(Na+)+ C(H+)=C(CH3COO-)+C(OH-)。将1式代入2式可得C(CH3COO-)﹥C(Na+)。盐的大量大于弱电解质的电离,所以C(Na+)﹥C(H+)。因此离子浓度的关系是:C(CH3COO-)﹥C(Na+)﹥C(H+)﹥C(OH-)。错误。C.1.0mol/LNa2CO3溶液中根据质子守恒可得:C(OH-)=C(HCO3-)+C (H+)+2C(H2CO3)。正确。D.某二元弱酸的酸式盐NaHA溶液中,根据电荷守恒可得:C(H+)+C(Na+)=C(OH-)+C(HA-)+2C(A2-)。错误。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.水电离出的c(H+)减小 | B.c(OH-)与c(H-)的乘积增大 |
| C.c(H+)减小 | D.c(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
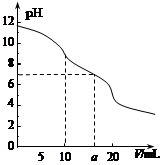
| A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-) |
| B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-) |
| C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3) |
| D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(OH-)>c(H+) |
| B.c(CH3COOH)>c(CH3COO-) |
| C.c(Na+)>c(CH3COO-) |
| D.c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将过量CO2气体通入水玻璃中可制得硅酸和纯碱 |
B.标准状况下,2.24L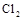 与过量稀NaOH溶液反应,转移电子0.1mol 与过量稀NaOH溶液反应,转移电子0.1mol |
| C.1L2mol·L-1明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 |
| D.漂白粉溶于水能导电,故漂白粉是电解质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 金属 | 熔点(℃) | 沸点(℃) |
| 钙 | 841 | 1487 |
| 镧 | 920 | 3470 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液 | 溶液变成红色 | Fe(NO3)2试样已变质 |
| B | 将少量某无色气体通入澄清石灰水 | 出现白色沉淀 | 该气体一定是CO2 |
| C | 分别测定常温下0.1 mol·L-1 Na2SiO3溶液和Na2CO3溶液的pH | pH:Na2SiO3> Na2CO3 | 非金属性:Si>C |
| D | 向浓度均为0.1 mol·L-1 NaCl和NaI混合溶液中,滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H++HB- ②HB-
H++HB- ②HB- H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )| A.NaHB属于弱电解质 |
| B.溶液中的离子浓度[Na+]>[HB-]>[H+]>[OH-] |
| C.[Na+]=[HB-]+[B2-]+[H2B] |
| D.NaHB和NaOH溶液反应的离子方程式为H++OH-=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com