
分析 (1)容量瓶的规格需要根据配制的溶液体积进行选择,根据配制250mL0.1mol/L的盐酸溶液的步骤选用仪器;
(2)根据配制250mL0.1mol/L的盐酸溶液的步骤进行解答;
(3)根据配制过程中的错误操作对物质的量浓度c=n/V的影响分析引起的误差.
解答 解:(1)配制250mL0.1mol/L的盐酸溶液,需要选用规格为250mL的容量瓶,根据配制步骤可知,配制过程中需要使用的仪器为:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,还缺少的仪器为:胶头滴管,
故答案为:250;胶头滴管;
(2)配制250mL0.1mol/L的盐酸溶液的步骤为:计算、量取、冷却、转移、洗涤、定容和摇匀,
故答案为:FBCAED;
(3)加蒸馏水时不慎超过了刻度,会导致配制的溶液体积偏大,溶液的浓度偏低,
定容时俯视容量瓶刻度线,会导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,
溶液未冷却,热的溶液体积偏大,冷却后体积会变小,会导致配制的溶液体积偏小,配制的溶液浓度偏高,
故答案为:偏低;偏高;偏高.
点评 本题考查了配制一定物质的量浓度的溶液的方法,题目难度中等,该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生严谨的规范实验操作能力.


科目:高中化学 来源: 题型:选择题
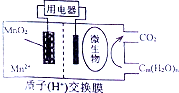
| A. | MnO2极为负极 | |
| B. | Cn(H2O)m发生了氧化反应 | |
| C. | 电子从负极区经交换膜移向正极区 | |
| D. | 放电过程中,H+从正极区移向负极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题.
欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤①⑥⑦④ | B. | ④⑥①③②⑤⑦ | C. | ④②⑤⑥①③⑦ | D. | ②⑥⑦④③⑤① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 升高温度 | D. | 加入少量氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1氨水,溶液的pH>13 | |
| B. | 0.1 mol•L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 | |
| C. | 0.1 mol•L-1醋酸溶液中:c(H+)=c(CH3COO-) | |
| D. | 0.1 mol•L-1醋酸与0.1 mol•L-1NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com