
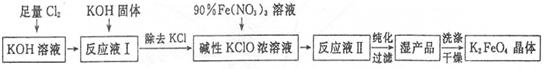
 2NaOH + H2�� + Cl2����2�֣�
2NaOH + H2�� + Cl2����2�֣�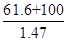 =109.9ml=0.11L�ɵ�C(KOH)= 10 mol��L-1����7������������ԭ�����غ㣬2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O
=109.9ml=0.11L�ɵ�C(KOH)= 10 mol��L-1����7������������ԭ�����غ㣬2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Al2O3 | B������CaCO3 | C���������NaCl | D���Ȼ��������۸��¹��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

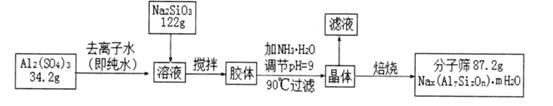
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
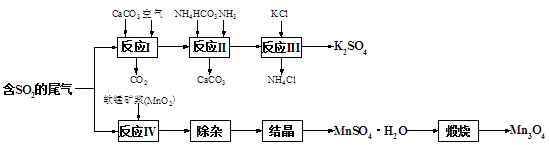
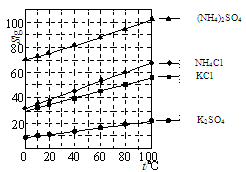

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

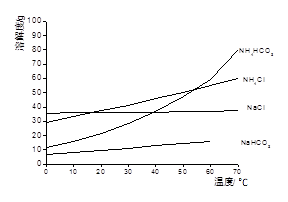
| ���� | ���볣����25�棩 |
| H2CO3 | K1=4.4X10��7 K2=4.7X10��11 |
| H2SO3 | K1=1.23X10��2 K2=5.6X10��8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڢۢޢ� | B���٢ܢ� | C���ۢޢߢ� | D���٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
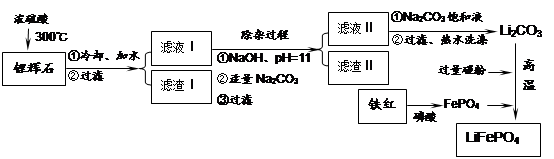
 Li2SO4 + Al2O3��4SiO2��H2O��
Li2SO4 + Al2O3��4SiO2��H2O��| �¶�/�� | 20 | 40 | 60 | 80 |
| �ܽ��(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| �ܽ��(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
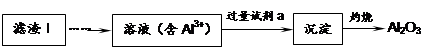
 LiFePO4������еĹ������ʿɴ���Li������д���õ�طŵ�ʱ��������Ӧ�� �����øõ�ص�ⱥ��ʳ��ˮ�����ص缫��Ϊ���Ե缫������������������4480mL���壨��״��������ʱ���õ������﮵�����Ϊ ��
LiFePO4������еĹ������ʿɴ���Li������д���õ�طŵ�ʱ��������Ӧ�� �����øõ�ص�ⱥ��ʳ��ˮ�����ص缫��Ϊ���Ե缫������������������4480mL���壨��״��������ʱ���õ������﮵�����Ϊ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ú�ĸ����������仯 |
| B��ú��������Һ����ҪĿ����Ϊ�˻�ýϽྻ����Դ |
| C��������Ҫ����ʯ�͵��ѽ� |
| D����ϩ������ʯ�͵��ѻ����ѽ����Ҫ����ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����������Ȼ������� | B���������������� |
| C������Ȼ�����Һ���� | D���Ȼ��������۸��¹������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com