
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含苯废水 | 用活性炭吸附 | 物理法 |
| D | 含纯碱的废水 | 加石灰水反应 | 化学法 |
科目:高中化学 来源:不详 题型:填空题

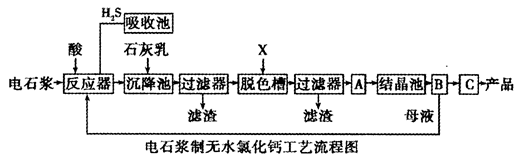
| A.水 | B.浓硫酸 | C.石灰乳 | D.硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
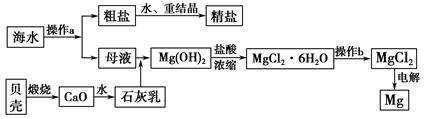
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a口进水 |
| B.b口进精制饱和食盐水 |
| C.c口出的是Cl-,是由b口进入的 |
| D.d口出的是H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
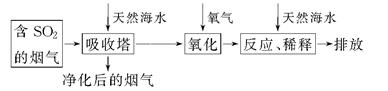
| A.天然海水pH≈8的原因是海水中的CO32—、HCO3—水解 |
| B.“氧化”是利用氧气将H2SO3、HSO3—、SO32—等氧化生成SO42— |
| C.“反应、稀释”时加天然海水的目的是中和、稀释经氧气氧化后海水中生成的酸 |
| D.“排放”出来的海水中SO42—的物质的量浓度与进入吸收塔的天然海水相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.海水资源的利用包括海水水资源利用和化学资源利用 |
| B.海水既苦又涩,不能直接利用 |
| C.海水中某些金属元素总储量很大,但富集程度却很低 |
| D.海水淡化应同化工生产结合,同能源技术结合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2、Br2、I2 | B.Na、Mg、Al |
| C.食盐、淡水 | D.NaOH、H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
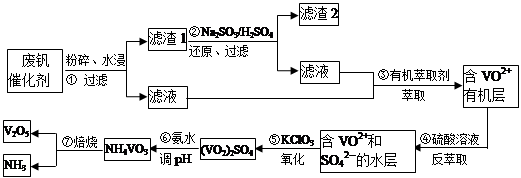
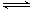 VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是_____________。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是_____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
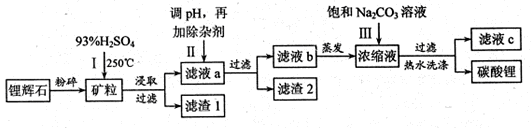
 Li2SO4+Al2O3·4SiO2?H2O
Li2SO4+Al2O3·4SiO2?H2O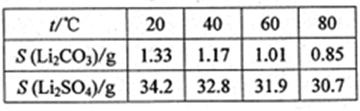
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com