
| ||
| ||
| a |
| 3 |
| a |
| 3 |
| 22.4a |
| 3 |
| 22.4a |
| 3 |
| 2xmol |
| 4 |
| x |
| 2 |
| (1-x)mol×2 |
| 2 |
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| 2xmol |
| 4 |
| x |
| 2 |
| (1-x)mol×2 |
| 2 |
| x |
| 2 |
| 6 |
| 11 |
| 6 |
| 11 |
| 5 |
| 11 |


科目:高中化学 来源: 题型:
| A、c(OH-)>c(H+) |
| B、c(CH3COO-)=0.1 mol?L-1 |
| C、c(Na+)>c(CH3COO-) |
| D、c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 |
| B、二氧化硅可用作光导纤维 |
| C、石英玻璃耐强酸强碱,可用来制造化学仪器 |
| D、Si3N4是一种新型无机非金属材料,可用于制造发动机 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
- 3 |
| A、IBr加入Na2S溶液中产生黄色浑浊:IBr+S2-═I-+Br-+S↓ | ||
B、IBr加入KI溶液中:IBr+2I-═Br-+I
| ||
| C、IBr加入NaOH溶液中:IBr+2OH-═BrO-+I-+H2O | ||
D、IBr加入AgNO3溶液中:3IBr+5Ag++3H2O═3AgBr↓+2AgI↓+IO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
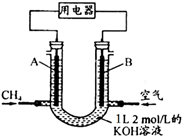 将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生反应:Cu2++2Br-
| ||||
| B、碳酸氢镁溶液中加入足量的烧碱溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | ||||
| C、过量SO2通入氨水中:SO2+2NH3?H2O═2NH4++SO32-+H2O | ||||
| D、碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com