
��ͼ1��ʾ��ijͬѧ�����һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ���밴Ҫ��ش�������⣺
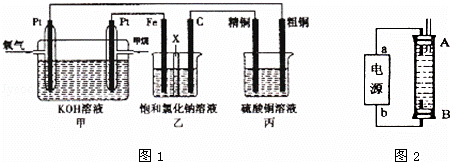
��1������ȼ�ϵ�ظ����缫��Ӧʽ�ǣ� ��
��2��ʯī�缫��C���ĵ缫��ӦʽΪ ��
��3�����ڱ�״���£���2.24L�����μӷ�Ӧ������װ�������缫�����ɵ��������Ϊ L����װ������������ͭ������Ϊ g��
��4��ijͬѧ������ȼ�ϵ����Ƶ�ⷨ��ȡƯ��Һ��Fe��OH��2��ʵ��װ�ã���ͼ2��ʾ����
��������Ư��ҺʱaΪ����������������Һ����� ��
��������Fe��OH��2��ʹ�����������������Һ������ѡ�������缫��
���㣺 ԭ��غ͵��صĹ���ԭ����
ר�⣺ �绯ѧר�⣮
������ ȼ�ϵ���У�Ͷ��ȼ�ϵĵ缫�Ǹ�����Ͷ���������ĵ缫��������
��1��ȼ�ϵ���У�������Ͷ��ȼ�ϣ�������ʧ���ӷ���������Ӧ��
��2������Ͷ���������ĵ缫��������������װ����ʯī��������������������ʧ���ӷ���������Ӧ��
��3�����ݴ��������ת�Ƶ�������ȼ������缫�������������������װ��������ͭ��������
��4����ⱥ��ʳ��ˮʱ�����������������������������������������������Ʒ�Ӧ���ɴ������ƣ�����������Ư��Һ����Ч�ɷ֣���������Fe��OH��2��ʹ�����������������Һ�������������ӷŵ�������������������ʧ���������������ӣ��������Ӻ��������Ʒ�Ӧ����������������
��� �⣺ȼ�ϵ���У�Ͷ��ȼ�ϵĵ缫�Ǹ�����Ͷ���������ĵ缫��������
��1��ȼ�ϵ���У�������Ͷ��ȼ������Ͷ�ż���ĵ缫�Ǹ�����������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��
CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O��
�ʴ�Ϊ��CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O��
��2������Ͷ���������ĵ缫��������������װ����ʯī�缫��������������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ��2Cl﹣﹣2e﹣=Cl2����
�ʴ�Ϊ��2Cl﹣﹣2e﹣=Cl2����
��3�����������ת�Ƶ�������ȣ����ڱ�״���£���2.24L�����μӷ�Ӧ����ת�Ƶ��ӵ����ʵ���=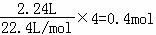 ����װ�������缫�������ӷŵ��������������������������ΪxL����װ��������������ͭ��������ͭ������Ϊyg��
����װ�������缫�������ӷŵ��������������������������ΪxL����װ��������������ͭ��������ͭ������Ϊyg��
2H++2e﹣=H2��
2mol 22.4L
0.4mol xL
x=4.48
2Cu 2++2e﹣=Cu
2mol 64g
0.4mol yg
y=12.8
�ʴ�Ϊ��4.48��12.8��
��4����ⱥ��ʳ��ˮʱ�����������������������������������������������Ʒ�Ӧ���ɴ������ƣ�����������Ư��Һ����Ч�ɷ֣�B�缫�������������������ܶ�С����Һ���ܶȣ��������ɵ������������ܺ�����������Һ��ֵĽӷ�Ӧ���ɴ������ƣ�����A����������������A��������������aΪ��ظ�������������Fe��OH��2��ʹ�����������������Һ�������������ӷŵ�������������������Ƕ��Ե缫�����������������ӷŵ����������ò�������������������������Ӧ������ʧ���������������ӣ��������Ӻ��������Ʒ�Ӧ����������������
�ʴ�Ϊ������������ʳ��ˮ������
������ ���⿼����ԭ��غ͵���ԭ�������ʵ������йؼ��㣬�ѵ��ǣ�4�����е������Һ��ѡȡ���缫���ϵ�ѡȡ������ʵ��Ŀ�Ľ�����ȷѡȡ���ɣ�


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijͬѧ��Na2CO3����0.10mol/L Na2CO3��Һ�Ĺ�����ͼ��ʾ������Ϊ��ͬѧ�Ĵ����У���

A�� �٢ݢ� B�� �ڢܢ� C�� �٢� D�� �ݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij����Һ��ֻ���ܺ���Ag+��Fe2+��Fe3+��Na+��Ba2+��CO32����NO3����SO42���еļ������ӣ����ν�������ʵ�飺
��ȡ��������Һ������������NaCl��Һ������������
�ڼ�������������Na2SO4��Һ���а�ɫ�������ɣ�
�۹��ˣ�ȡ������Һ����������NaOH��Һ���а�ɫ��״�������ɣ�Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ��
����ʵ������ش�
��1������Һ��һ����������������һ��û������������
д��������з�����Ӧ�����ӷ���ʽ������д��������г����ɰ�ɫ��Ϊ���ɫ�Ļ�ѧ����ʽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͼװ��ʵ�飬��x���ʾ���������ĵ��ӵ����ʵ�������y��ɱ�ʾ����
��c��Ag+����c��AgNO3����a����������b�������� ����Һ��pH��
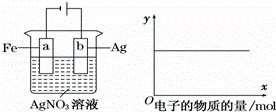
A�� �٢� B�� �ۢ� C�� �٢ڢ� D�� �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��a mol•L﹣1��Na2CO3��Һ��b mol•L﹣1��NaHCO3��Һ�������ϣ�������Һ������Ũ�ȼ�Ĺ�ϵ������жϲ���ȷ���ǣ���
A�� c��Na+��+c��H+����c��CO32﹣��+c��HCO3﹣��+c��OH﹣��
B�� c��Na+����c��CO32﹣��+c��HCO3﹣��+c��H2CO3��
C�� ��c��Na+����c��HCO3﹣����c��CO32﹣����c��OH﹣����c��H+������һ��a��b
D�� ��a=b������Һ��c��HCO3﹣����c��CO32﹣��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������£�һ���ܴ���������������ǣ���
A�� ��ɫ����ˮ��Һ�У�K+��Ba2+��I﹣��MnO4﹣
B�� ���д���NO3﹣��ˮ��Һ�У�NH4+��Fe2+��SO42﹣��H+
C�� c��HCO3﹣��=0.1mol•L﹣1����Һ�У�Na+��K+��CO32﹣��Br﹣
D�� ǿ������Һ�У�ClO﹣��S2﹣��HSO3﹣��Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ȷ��ʾ���з�Ӧ�����ӷ���ʽ�ǣ���
A�� Ũ��������м��Ӧ��2Fe+6H+═2Fe3++3H2��
B�� ����CuSO4��Һ��Ӧ��2Na+Cu2+═Cu��+2Na+
C�� NaHCO3��Һ��ϡH2SO4��Ӧ��CO32﹣+2H+═H2O+CO2��
D�� ��FeCl3��Һ�м���Mg��OH��2��3Mg��OH��2+2Fe3+═2Fe��OH��3+3Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ȷ��ʾ���з�Ӧ�����ӷ���ʽ���ǣ���
A�� ��������Һ�м��������ˮ��Al3++3OH﹣═Al��OH��3��
B�� ̼������Һ�м������ʯ��ˮ��Ca��OH��2+CO32﹣═CaCO3��+2OH﹣
C�� �������������Һ��ͨ��������Cl2+2OH﹣═ClO﹣+Cl﹣+H2O
D�� ϡ�����м������ۣ�2Fe+6H+═2Fe3++3H2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com