
| A. | ②③⑥⑦ | B. | ①②④⑦ | C. | ②③④⑥ | D. | ②③⑤⑦ |
分析 ①乙二酸俗称草酸;
②纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;
③纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;
④AgNO3溶液的Ag+水解,溶液呈酸性,加了氨水变碱性;
⑤氟氯代烷常用作制冷剂、灭火剂、溶剂等;
⑥丙三醇的水溶液熔点较低;
⑦苹果中含的酯是异戊酸异戊酯;
解答 解:①乙二酸通常以二水合物的形式存在,俗称草酸晶体,故①正确;
②电石的主要成分是碳化钙,是混合物,故②错误;
③冰醋酸是由一种物质组成的物质,是纯净物,故③错误;
④配制银氨溶液的过程是将氨水加入硝酸银溶液中直至过量,此过程中,先生成氢氧化银沉淀,然后生氢氧化银与过量氨水生成氢氧化二氨合银络合物,氢氧根浓度逐渐增大,故PH增大,故④正确;
⑤由于氟利昂化学性质稳定,具有不燃、低毒、介电常数低、临界温度高、易液化等特性,因而广泛用作冷冻设备和空气调节装置的制冷剂,故⑤正确;
⑥丙三醇的水溶液熔点较低,常用作防冻液,故⑥错误;
⑦苹果中含的酯是异戊酸异戊酯,故⑦错误.
故选A.
点评 本题是一道综合题考查知识点较多,主要是物质性质的理解应用,难度不大,注意知识的积累.


科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
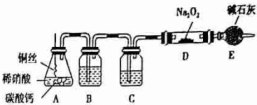
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电负性:He>F>O | B. | 第一电离能:O>N>P | ||
| C. | 离子半径:S2->Cl->Ca2+ | D. | 热稳定性:H2O>H2Se>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| B. | 我们所吃的豆腐中主要含有葡萄糖 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 奶制品的非法添加物三聚氰胺(市场上称“蛋白精”)是一种有毒蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com