
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是
A、金刚石属于金属单质 B、制造过程中元素种类没有改变
C、CCl4是一种化合物 D、这个反应是置换反应
科目:高中化学 来源: 题型:
氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构
式分别是 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
 (1)写出N2O4转化为NO2的热化学方程式:
(1)写出N2O4转化为NO2的热化学方程式:
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为
②n3 n4(填“>”、“<”或“=”),该反应的平衡常数K的值为 ,升高温度后,反应2NO2 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如下图所示:

下列描述正确的是
A.反应开始到10s,用Z表示的反应速率为0.158 mol/(L·s)-1
B.反应开始到l0s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10S时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g) Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.用FeCl3溶液腐蚀铜板制印刷电路板:Fe3++2Cu=Fe2++2Cu2+
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
D.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2 xH2O)。有如下操作:
xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。检验溶液A中Fe2+的最佳试剂为_____(填编号,下同)。
①KMnO4 ②(NH4)2S ③NaOH ④ KSCN
(2)氧化剂可选用_________。①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用_______________。①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是_____________(按实验先后顺序选填编号)。
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需_________,下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
(6)为了测定制得的氯化铜晶体(CuCl2 xH2O)中的x值,某学生设计了两种实验方案:
xH2O)中的x值,某学生设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是________,理由是___________,据此计算得x=_________(用含m、n1或n2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A可以通过不同的反应得到B和C:

(1)A的分子式为 ,C的含氧官能团名称为 。
(2)A制取B的有机反应类型为 ;A制取C的化学方程式为:
。
(3)A发生消去反应后产物的结构简式为 ,A分子中一定共面的碳原子有 个。
(4)芳香族化合物D是A的同分异构体,1molD可以和3mol NaOH发生中和反应;D苯环
上的一氯代物只有一种且分子中没有甲基。请写出D的结构简式 (任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据你所学的知识,回答下列问题:
(1)某元素最高化合价为+5,原子最外层电子数为2,半径是同族中最小的,其核外价电子构型为 ,属 区元素。
(2)某元素原子的价电子构型为4s24p3,它属于第 族,最高正化合价为 。
(3)原子序数为24的元素原子中有 个能级, 个未成对电子。
(4)S、O、N三种元素的第一电离能由大到小的顺序为 。
(5)与NO3-互为等电子体的是 。
①SO3 ②BF3 ③CH4 ④NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学----选修有机化学】(15分)
2004年,国家食品监督局发出“警惕食品中丙烯酰胺(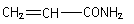
 )”的公告,丙烯酰胺具有中等毒性,它对人体可造成神经毒性和遗传毒性。已知有机物H是丙烯酰胺的相邻同系物,A为气态烃,标准状况下密度为2.5g / L;F为六元环状化合物。回答下列问题:
)”的公告,丙烯酰胺具有中等毒性,它对人体可造成神经毒性和遗传毒性。已知有机物H是丙烯酰胺的相邻同系物,A为气态烃,标准状况下密度为2.5g / L;F为六元环状化合物。回答下列问题:
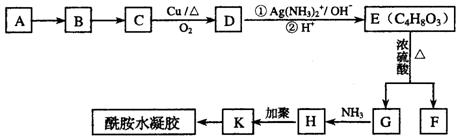
(1)写出G的结构简式____________________、K的结构简式_____________________
(2)指明下列反应类型:A→B、___________________E→G;___________________;
(3)写出下列化学方程式:
C→D_________________________________________________________________
E→F_________________________________________________________________
(4)下列关于丙烯酰胺的说法,不正确的是________;
①丙烯酰胺可以溶于水和有机溶剂 ②人们应改善膳食习惯,少食油炸食品
③1mol丙烯酰胺最多可和2mol氢氢气发生反应 ④丙烯酰胺有毒,人们要杜绝使用
(5)写出有机物H的同种类别的同分异构体的结构简式:
________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com