
下列条件一定能使反应速率加快的是( )
① 增加反应物的物质的量;② 升高温度;③ 缩小反应容器的体积;④ 加入生成物;⑤ 加入MnO2
A. 全部 B. ①②⑤ C. ② D. ②③
科目:高中化学 来源: 题型:
X+的核外各层电子数分别为2、8,则X元素在周期表中的位置是( )
A.第2周期第0族 B.第3周期第ⅠA族
C.第2周期第ⅠA族 D.第2周期第ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A与氢气的相对密度是38,取有机物A 7.6 g完全燃烧后,生成0.2 mol CO2和0.2 mol H2O。此有机物可与氢氧化钠和碳酸钠反应。
下列有关A的说法中不正确的是
A.A的分子式为C2H4O3
B.A的结构简式为HO—CH2—COOH
C.1 mol A与足量的单质Na反应时放出H2的物质的量为1.0 mol
D.A分子中的官能团有两种,这两种官能团之间不能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 | 35 mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
由此得出的结论正确的是 ( )。
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是 ( )
A. 已知2H2(g)+O2(g)=2H2O(l) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为483.6 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知2C(s)+2O2(g)=2CO2(g) ΔH1 2C(s)+O2(g)=2CO(g) ΔH2 则ΔH1>ΔH2
D.已知Ni(CO)4(s)=Ni(s)+4CO(g) ΔH=Q kJ·mol-1,则Ni(s)+4CO(g)=Ni(CO)4(s) ΔH=-Q kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:4 NH3 + 5 O2 = 4 NO + 6 H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)(mol/(L•s))表示,则正确的关系是( )
A.v(O2)=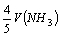 B. v(H2O)=
B. v(H2O)=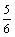 v(O2)
v(O2)
C. v(H2O)=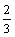 v(NH3) D. v(NO)=
v(NH3) D. v(NO)=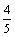 v(O2)
v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的定容密闭容器中,当物质的下列物理量不再发生变化时,不能表明该反应A(s)+2B(g)
 C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
A.混合气体的密度 B.混合气体的总物质的量
C.混合气体的平均相对分子质量 D.体系的温度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列两个图像:
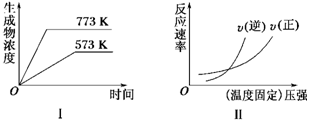
下列反应中符合上述图像的是( )
A.N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
B.2SO3(g)  2SO2(g)+O2(g) ΔH>0
2SO2(g)+O2(g) ΔH>0
C.4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
D.H2(g)+CO(g)  C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤 如下:
如下:

请回答下列问题:
硫酸与二氧化钛反应的化学方程式是____________________________________。
(1) 向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、____________________。
(2) 在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水 解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________
解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________ ________。
________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是 :将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com