
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | R | |||||||||||||||||
B | C | D | E | F | T | |||||||||||||
G | H | I | J | K | L | |||||||||||||
M | N | O | ||||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X高温下反应的化学方程式______。
(2)D的简单气态氢化物的VSEPR模型的名称为______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数=______。
(4)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是______(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______。
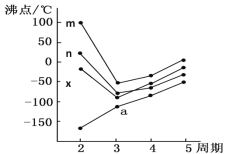
(5)如图四条折线分别表示ⅣA族、Ⅴ/span>A族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是______(填m、n、x或y)。
【答案】8Al+3Fe3O4![]() 4Al2O3+9Fe 四面体 1:1 非极性
4Al2O3+9Fe 四面体 1:1 非极性 ![]() m
m
【解析】
A为H,R为He,B为Li,C为C,D为N,E为O,F为F,T为Ne,G为Na,H为Mg,I为Al,J为Si,K为S,L为Cl,M为Cr,N为Fe,O力Cu,据此解答。
(1)Fe的单质和水蒸汽反应能生成固体Fe3O4,则Al与Fe3O4反应生成Fe和Al2O3,其化学方程式8Al+3Fe3O4![]() 4Al2O3+9Fe,故答案为:8Al+3Fe3O4
4Al2O3+9Fe,故答案为:8Al+3Fe3O4![]() 4Al2O3+9Fe;
4Al2O3+9Fe;
(2)D的气态氢化物NH3,价层电子对数为4,VSEPR模型的名称为四面体,故案为:四面体;
(3)由A、C、D形成的ACD分子HCN,其结构为H-C≡N,σ键和π键个数比为1:1,故答案为:1:1;
(4)①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,CCl4、CS2是非极性分子,根据相似相溶原理得出ME2L2是非极性分子,故答案为:非极性;
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成Cu-Al-浓硝酸原电池,则组成负极材料是铜,其外围电子轨道表达式为![]() ,故本题答案为:
,故本题答案为:![]() ;
;
(5)如图四条折线分别表示ⅣA族、VA族、ⅥA族ⅦA族元素气态氢化物沸点变化,沸点最高的是H2O,因比m为H2O,n为HF,x为NH3,y为CH4,则E的氢化物为H2O,其所在的折线是m,故答案为:m。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】M、X、Y、Z为4种原子序数依次增大的短周期主族元素,其原子序数之和为22。已知M、Y形成的化合物使湿润的红色石蕊试纸变蓝色,M、Z形成化合物的水溶液可以蚀刻玻璃,4种元素形成某种化合物的结构式为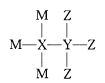 。下列说法正确的是
。下列说法正确的是
A.X、Y均不属于第ⅣA族元素
B.原子半径:Y>X>Z>M
C.M与Y、Z三种元素只能形成共价化合物
D.该化合物中每种原子的最外层都达到了8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
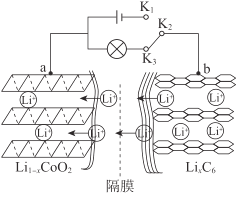
【题目】锂电池应用广泛,大致可分为锂金属电池和锂离子电池。锂离子电池工作原理:以石墨/锂钴氧电池为例,其总反应方程式为:LiCoO2+6C![]() Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
试回答下列问题:
(1)连接K1、K2时,a作___极。
(2)连接K2、K3时,被还原的物质是___。
(3)放电时,负极发生反应的电极反应式是___。
(4)锂离子电池的电极废料(含LiCoO2)中的金属可回收利用。
①将电极废料磨碎后用酸浸出,磨碎的目的是___。
②将电极废料用盐酸浸出,得到含Li+、Co2+的溶液,并有黄绿色气体生成,则该反应的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸丁酯的物理性质如表。
乙酸 | 1-丁醇 | 乙酸丁酯 | |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
实验室用如图所示的实验装置制取乙酸丁酯。
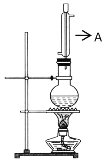
(1)仪器A的名称___。
(2)写出制取乙酸丁酯的化学方程式:__。
(3)该实验中生成物除了主产物乙酸丁酯外,还可能生成的有机副产物有__(写出一种结构简式)。
(4)酯化反应是一个可逆反应,为提高1-丁醇的转化率,可采取的措施是__(写出两条)。
(5)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,需要的是__(填答案编号)。
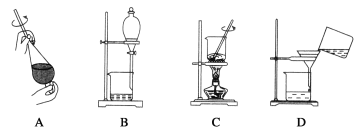
(6)用60g乙酸与37g1-丁醇反应,实验中得到乙酸丁酯的质量为40.6g,则乙酸丁酯的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有4种物质:碳酸氢钠、硫酸钡、烧碱、苯。(以下必须填写化学式)
(1)属于碱的是________________;
(2)属于硫酸盐的是________________;
(3)属于酸式盐的是________________;
(4)属于有机物的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。

下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如图:
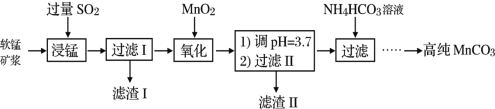
(1)为了提高“浸锰”过程中原料的浸出率,可以采取的措施有___(写一条。)
(2)浸锰过程中Fe2O3与SO2反应的化学方程式为:Fe2O3+SO2+2H+=2Fe2++SO![]() +H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。
+H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。
(3)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为___(填离子符号)。
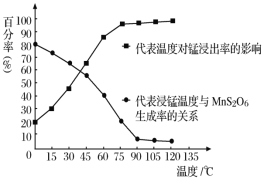
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___。
(5)写出“氧化”过程中MnO2与SO2反应的化学方程式___。
(6)滤渣Ⅱ是___(填化学式)。
(7)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末X中可能含有K2SO4、(NH4)2CO3、K2SO3、NaNO3、Cu2O、FeO、Fe2O3中的若干种。某同学为确定该固体粉末的成分,取X进行如下实验,实验过程及现象如图所示。该同学得出的结论不正确的是( )

已知:Cu2O+2H+=Cu2++Cu+H2O
A.根据现象1无法推出固体粉末中是否含有NaNO3
B.根据现象2可推出白色沉淀是BaSO4
C.根据现象3可推出固体粉末中一定含有K2SO3
D.根据现象4可推出固体粉末中的氧化物只有FeO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com