
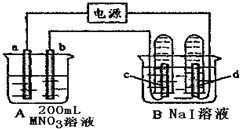
分析 (1)接通电源,金属M沉积于b极,同时a、d电极上产生气泡,则b为阴极,M离子在阴极放电生成金属单质,则a为阳极,d为阴极,氢离子放电;
(2)B中I-在c极上放电,电解一段时间后,OH-也放电;
(3)根据串联电路中以及电解池中阴、阳两极得失电子数目相等求出气体的物质的量和金属的物质的量,最后根据M=$\frac{m}{n}$求出金属的摩尔质量.
解答 解:(1)1)接通电源,金属M沉积于b极,同时a、d电极上产生气泡,则b为阴极,M离子在阴极放电生成金属单质,则a为阳极,c为阳极,电极反应为2I--2e-=I2,故答案为:阳极;2I--2e-=I2;
(2)B中I-在c极上放电生成碘单质,遇淀粉变蓝,电解一段时间后,OH-也放电,电极反应为4OH--4e_=2H2O+O2↑,
故答案为:4OH--4e_=2H2O+O2↑;
(3)n(H2)=$\frac{0.0448L}{22.4L/mol}$=0.002mol,则转移电子为0.004mol,a电极反应为4OH--4e_=2H2O+O2↑,所以生成氧气为0.001mol,由H2~2e-~2M可知,则n(M)=0.004mol,所以金属的摩尔质量为$\frac{0.432g}{0.004mol}$=108g/mol,
故答案为:0.001;108g/mol.
点评 本题考查电解原理,明确惰性电极电解时离子的放电顺序及发生的电极反应是解答本题的关键,注意转移的电子守恒来解答,题目难度中等,侧重于考查学生的分析能力和计算能力.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:解答题
 ,
,
 ,D
,D ,E
,E .
.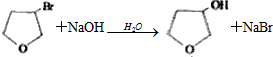 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
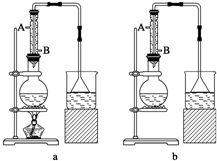
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.5 mol•L-1 | D. | 0.15 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| B. | 增大压强,平衡右移,K平衡增大 | |
| C. | B的平衡转化率是40% | |
| D. | 其他条件不变,向平衡体系中加入少量C,v正、v逆均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是吸热反应 | |
| B. | 断裂1mol A-A键和1mol B-B键能放出xkJ的能量 | |
| C. | 断裂2mol A-B键需要吸收ykJ的能量 | |
| D. | 2mol AB的总能量高于1 mol A2和1mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫能漂白某些物质,说明它具有氧化性 | |
| B. | 二氧化硫的水溶液能使紫色石蕊试液变红,说明它能与水反应生成H2SO3 | |
| C. | 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性 | |
| D. | 将等体积的SO2和Cl2混和后通入滴有石蕊的水中,溶液的颜色将变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
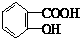 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备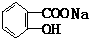
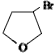
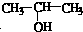 与NaOH的醇溶液共热制备CH3-CH=CH2.
与NaOH的醇溶液共热制备CH3-CH=CH2.| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com