
科目:高中化学 来源: 题型:

| 溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在25℃时,向100mL含HCl 14.6g的盐酸溶液里放入5.6g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末,收集到1.12L(标准状况)H2,又经过4min,铁粉完全溶解.则:
(1)在25℃时,向100mL含HCl 14.6g的盐酸溶液里放入5.6g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末,收集到1.12L(标准状况)H2,又经过4min,铁粉完全溶解.则:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
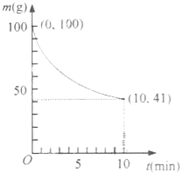 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:| 50℃ |
| 230℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“雾霆夭气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物有关 |
| B、乙醇、乙酸和甲醛广泛用于食品加工 |
| C、蛋白质、纤维素、油脂、天然橡胶都是天然高分子化合物 |
| D、橙子、柠檬一类的水果口感虽然酸,但是属于碱性食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3可与水反应生成Al(OH)3 |
| B、铝是地壳中含量最多的金属元素 |
| C、Al2O3是两性氧化物 |
| D、Al(OH)3沉淀可以溶于盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com