
分析 (1)根据n=$\frac{m}{M}$计算Al的物质的量;
(2)发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据方程式计算NaOH的物质的量,根据c=$\frac{n}{V}$计算其物质的量浓度;
(3)根据方程式计算氢气的物质的量,再根据V=n•Vm计算其体积.
解答 解:(1)10.8gAl的物质的量为:$\frac{10.8g}{27g/mol}$=0.4mol,
答:10.8gAl的物质的量为0.4mol;
(2)设参加反应的NaOH的物质的量为x mol,则:
2Al+2H2O+2NaOH=2NaAlO2+3H2↑
2 2
0.4mol xmol
则:2:2=0.4mol:x mol,解得:x=0.4,
故NaOH溶液的物质的量浓度为:$\frac{0.4mol}{0.5L}$=0.8mol/L,
答:参加反应的NaOH的物质的量为0.4mol,NaOH溶液的物质的量浓度为0.8mol/L;
(3)设生成氢气的物质的量为y mol,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3
0.4mol ymol
则:2:3=0.4mol:y mol,解得:y=0.6,
所以生成氢气在标准状况下的体积为:0.6mol×22.4L/mol=13.44L,
答:生成氢气的体积为13.44L.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握物质的量与气体摩尔体积、摩尔质量之间的关系,试题培养了学生的化学计算能力.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:推断题
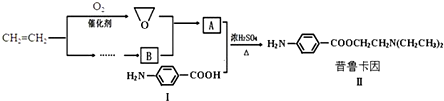

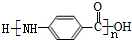 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式为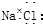 ? ? | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 氯化氢分子的形成过程可用电子式表示为:H×+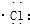 → →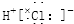 | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .F1和F2的关系为同分异构体.
.F1和F2的关系为同分异构体. ,二烯烃的通式是CnH2n-2.
,二烯烃的通式是CnH2n-2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧瓶必须垫石棉网加热 | |
| B. | 冷凝管中的水流是从下口进入,上口排出 | |
| C. | 实验中需要在烧瓶中加入几粒碎瓷片,防止出现暴沸现象 | |
| D. | 温度计的水银球应插入烧瓶中的液面以下 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3═2Al3++3SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Ba(OH)2═Ba2++(OH-)2 | D. | Na2SO3═Na++SO32- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学卷(解析版) 题型:填空题
(1)在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇;CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
① 则该反应的△S________0,△H_________0 (填“<”、“>”或“=”)。
② 若容器容积不变,下列措施可提高CO转化率的是________.
A.升高温度 B.将CH3OH从体系中分离
C.充入He,使体系总压强增大 D.再充入lmolCO和3 molH2
(2)以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+ H2O(g) CO(g)+3H2(g) △H =+206.0kJ/mol
CO(g)+3H2(g) △H =+206.0kJ/mol
II:CH3OH(g) CO(g)+2H2(g) △H =+129.0kJ/mol CH4(g)和 H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为__________。
CO(g)+2H2(g) △H =+129.0kJ/mol CH4(g)和 H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为__________。
(3)在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g) △H<0。改变下列条件能加快化学反应速率的是________
2HI(g) △H<0。改变下列条件能加快化学反应速率的是________
(a)保持容器容积不变,向其中加入1molH2。
(b)保持容器容积不变,向其中加入1molN2。(N2不参加反应)。
(c)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应)。
(d)保持容器内气体压强不变,向其中加入1molH2(g)和1molN2(g)。
(e)提高起始的反应温度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com