
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为V(Z)= __________。
(3)2min反应达平衡,容器内混合气体的平均相对分子质量比起始时______(填增大、减小或不变);混合气体密度比起始时_______(填增大、减小或不变).
(4)将amolx与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a:b=__________。
(5)下列措施能加快反应速率的是_________。
A.恒压时充入He;B.恒容时充入He;C.恒容时充入X;D.及时分离出Z;E.升高温度; F.选择高效的催化剂
(6)下列说法正确的是__________。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率加快,正反应速率大于逆反应速率
F.加入高效催化剂可加快正、逆反应速率,化学平衡正向移动
【答案】 3X(g)+Y(g)![]() 2Z(g) 0.05mol/(L·min) 增大 不变 5:3 CEF ACE
2Z(g) 0.05mol/(L·min) 增大 不变 5:3 CEF ACE
【解析】(1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式。
(2)根据V(Z)= c(Z)/ t计算反应速率V(Z)。
(3)混合气体的平均相对分子质量M=m/n,混合气体密度ρ=m/V来判断。
(4)根据化学反应中的三行式进行计算。
(5)根据影响化学反应速率的因素分析,升温、增压等均能加快反应速率。
(6)A.反应伴随能量变化,升高温度改变化学反应的限度;B.升高温度正逆反应速率均加快;C.化学反应的限度与反应物性质和外部因素有关,与时间长短无关;D.化学反应的限度与反应物性质和外部因素有关,是可能改变的; E.增大Y的浓度,正反应速率加快,逆反应速率同时加快。
(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且n(X): n(Y): n(Z)=0.3:0.1:0.2=3:1;2,则反应的化学方程式为: 3X(g)+Y(g)![]() 2Z(g);正确答案: 3X(g)+Y(g)
2Z(g);正确答案: 3X(g)+Y(g)![]() 2Z(g)。
2Z(g)。
(2)在2min时间内,用Z表示反应的平均速率V(Z)= c(Z)/ t=0.2/2×2=0.05mol/(L·min) ;正确答案: 0.05mol/(L·min)。
(3)混合气体的平均相对分子质量M=m/n,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,混合气体密度ρ=m/V,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变;正确答案:增大;不变。
(4) 3X(g)+ Y(g) ![]() 2Z(g)(设Y的变化量是x)
2Z(g)(设Y的变化量是x)
初始量 a b 0
变化量 3x x 2x
平衡量 a-3x b- x 2x
当n(X)=n(Y)=n(Z), a-3x=b- x=2x,则a=5 x,b=3x,所以原混合气体中a:b=5:3;正确答案:5:3。
(5)A.恒压时充入He,体系分压减小,反应速率减小,故错误;B.恒容时充入He,不影响体系压强和浓度,反应速率不变,故错误;C.恒容时充入X,X的浓度增大,反应速率加快,故正确;D.及时分离出Z,浓度不增加,压强减小,平衡右移,反应速率不加快,故错误;E.升高温度,任何化学反应速率加快,故正确;F.选择高效的催化剂,反应速率加快,故正确;正确答案:CEF。
(6)A.反应伴随能量变化,升高温度改变化学反应的限度,故正确;B.升高温度正逆反应速率均加快,故错误;C.化学反应的限度与反应物性质和外部因素有关,与时间长短无关,故正确; D.化学反应的限度与反应物性质和外部因素有关,是可能改变的,故错误;E.增大Y的浓度,正反应速率加快,逆反应速率同时加快,故正确;F.加入高效催化剂可加快正、逆反应速率,但是加快程度相同,所以化学平衡不发生移动,F错误;正确答案:ACE。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】
有机化合物G是一种生物降解塑料,其合成路线如下:

己知:①![]() (R1、R2表示烃基)
(R1、R2表示烃基)
②E不能与银氨溶液发生反应,但能与Na反应。
③
(1)A的化学名称为________
(2)生成B的反应类型为________,生成C的反应类型为________
(3)由B生成C的化学方程式为________
(4)G的结构简式为________
(5)E的同分异构体很多,能同时满足下列条件的链状化合物共有________种(不含立体异构),其中核磁共振氢谱有4组峰值,且峰面积比为2:2:1:1的结构简式为_______。
①含有三种官能团;②能与新制的Cu(OH)2悬独液反应;③氧原子不与碳碳双键相连④与Na反应可放出氢气。
(6)写出用苯和CH3COCl为原料制备化合物![]() 的合成路线(无机试剂任选):_____。
的合成路线(无机试剂任选):_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 molL﹣1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )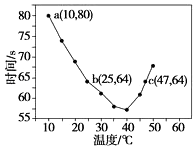
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中a点对应的NaHSO3反应速率为5.0×10﹣5 molL﹣1s﹣1
C.图中b、c两点对应的NaHSO3反应速率相等
D.40℃之后,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO为8mol.下列说法正确的是( )
A.保持其他条件不变,升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7 mol
D.CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A.分子式相同的有机物是同一物质
B.分子组成相差 1 个或 n 个CH2原子团的物质互称为同系物
C.分子式相同而结构不同的有机物一定互为同分异构体
D.两种化合物互为同分异构体,则它们有可能互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是
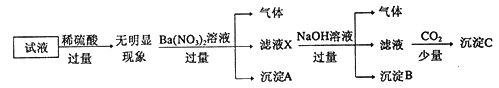
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程不涉及化学变化的是
A.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的变化过程
B.苯加入溴水振荡、静置,溴水褪色
C.植物油氢化得到人造脂肪
D.氢氧燃料电池放电时化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应C(s)+H2O(g)H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.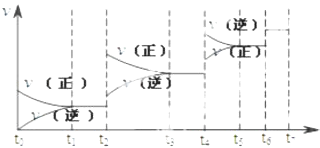
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是、;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com