
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+3OH-═Al(OH)3 | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-3e-═Fe3+ | |
| D. | 由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解500mL硝酸银溶液,当消耗铜电极32 g时,电解池溶液中pH=2 |
分析 A.原电池放电时,铝易失去电子而作负极,原电池中阴离子向负极移动;
B.原电池中,失电子发生氧化反应的电极是负极,该原电池中,铝和氢氧化钠反应而失去电子,则铝作负极;
C.原电池中,负极上失电子发生氧化反应,该原电池中,铁易失去电子而作负极;
D.Al、Cu、浓硝酸组成的原电池中,铝和浓硝酸发生钝化现象,铜和浓硝酸发生反应而失去电子,则铜作负极,用此电极电解硝酸银时,根据转移电子数相等计算pH.
解答 解:A.该原电池中,铝易失去电子而作负极,负极反应式为:Al-3e-=Al3+,原电池中阴离子向负极移动,所以放电时SO42-向Al电极移动,故A正确;
B、由Mg、Al、NaOH溶液组成原电池,铝和氢氧化钠反应易失去电子而作负极,镁作正极,其负极反应式为:Al-3e-+4OH-═AlO2-+2H2O,故B错误;
C.该原电池中,铁易失去电子而作负极,铜作正极,其负极反应式为:Fe-2e-═Fe2+,故C错误;
D、当消耗铜电极32 g时,物质的量为0.5mol,所以转移电子的物质的量为1mol,所以阳极的电极反应式为:2H2O-4e-=O2↑+4H+,所以产生氢离子的物质的量为:1mol,氢离子的浓度为:$\frac{1mol}{0.5L}$=2mol/L,故D错误;
故选A.
点评 本题考查了原电池原理,易错选项是B和D,注意不能根据金属的活泼性确定原电池的正负极,要根据电极反应类型判断原电池的正负极,为易错点.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力、范德华力、范德华力 | B. | 范德华力、范德华力、共价键 | ||
| C. | 范德华力、共价键、共价键 | D. | 共价键、共价键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

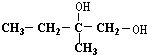 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2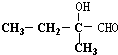 +2H2O.
+2H2O. $→_{△}^{浓H_{2}SO_{4}}$CH3CH=C(CH3)COOH+H2O.
$→_{△}^{浓H_{2}SO_{4}}$CH3CH=C(CH3)COOH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤液中一定有Fe2(SO4)3和FeSO4 | |
| B. | 滤液中可能有CuSO4,一定有FeSO4、ZnSO4 | |
| C. | 滤渣中一定有Cu和Fe,一定无Zn | |
| D. | 滤渣中可能有Cu、Fe和Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42-、Na+、HCO3- | B. | CO32-、K+、Na+ | C. | Na+、SO42-、C1- | D. | NH4+、Fe3+、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
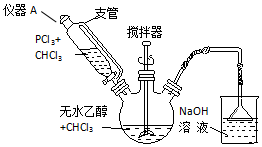
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com