
有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验 装置 |
|
|
|
|
部分实验现象 | a极质量减小b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向 a极 |
由此可判断这四种金属的活动性顺序是
A.d>a>b>c B. a>b>c>d C. b>c>d>a D. a>b>d>c
科目:高中化学 来源:2015-2016学年福建省高二上学期半期考试化学试卷(解析版) 题型:选择题
由下列6种基团中的2个不同基团两两组合,形成的物质能与NaOH反应的有
①—OH ②—CH3 ③—COOH ④ ⑤—CHO ⑥—H
⑤—CHO ⑥—H
A.4种 B.5种 C.6种 D.7种
查看答案和解析>>
科目:高中化学 来源:2016届福建省福州市高三上学期期中测试化学试卷(解析版) 题型:实验题
(15分)工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).
(1)实验原理:①Al4C3与硫酸反应可生成CH4.②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与过量NaOH溶液反应的化学方程式_____________________________。
(2)实验装置(如图所示):
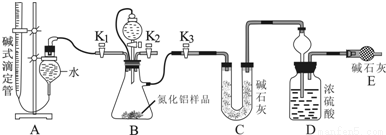
(3)实验过程:
①连接实验装置,检验装置的气密性.称得D装置的质量为yg,滴定管的读数为amL。
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。
③待反应进行完全后,关闭活塞___________,打开活塞____________,通过分液漏斗加入过量________(填化学式),与装置B瓶内物质充分反应。
④ _____________(填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L•mol-1)
①Al4C3的质量分数为___________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
③AlN的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期质量监测化学试卷(解析版) 题型:填空题
(15分)发生在天津港“8·12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注。
(1)为了减少空气中SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为: 。
(2)由于CaC2、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难。如果在实验室,你处理金属钠着火的方法是 。
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染。处理NaCN的方法是:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
(4)电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+=5O2↑+2N2↑+2H2O,则阴极反应式为 。

(5)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。已知在常温下:Ksp[Fe(OH)2]= 1×10-15、Ksp[Fe(OH)3]= 1×10-38 、Ksp[Cr(OH)3]= 1×10-23 ,当离子浓度在1×10-5mol/L以下时认为该离子已经完全沉淀,请回答:
①相同温度下Fe(OH)3的溶解度 Cr(OH)3的溶解度(填“>”、“<”或“=”)
②浓度为0.1mol/L的Fe2+与10. 0mol/L Cr3+同时生成沉淀的pH范围是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期10月联考化学试卷(解析版) 题型:填空题
金属冶炼和处理常涉及电化学反应。
(1)冶炼或冶炼提纯下列相应金属时没有采用到电解法的是
a.Fe b.Na c.Cu d.Al
(2)右图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银;电解过程中,若b极伴有少量无色气体生成,在空气中变红棕色,则生成气体的电极反应式为____________________

(3)银白光亮的银器用久后表面易出现黑斑(Ag2S),为处理黑斑,将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
(4)右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质为CuSO4溶液(足量)。通电一定时间后,A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g ,则A合金中Cu、Zn原子个数比为 。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:选择题
常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L
D.c(Na+)=c(Y-)+c(HY)=0.3 mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期10月月考化学试卷(解析版) 题型:选择题
下列说法中有明显错误的是
A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.活化分子之间发生的碰撞一定为有效碰撞
C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
D.加适宜的催化剂,可使活化分子的百分数大大增加,从而增大反应速率
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期10月联考化学试卷(解析版) 题型:选择题
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通人 SO2气体,溶液逐渐变成无色。下列分析不正确的是
A.滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀
B.通入SO2后溶液逐渐变成无色,不是 SO2的漂白性
C.通入SO2时,SO2与I2反应,I2作氧化剂
D.上述实验条件下,物质的氧化性:Cu2+ >I2 > SO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第一次月考化学试卷(解析版) 题型:填空题
(1)化学反应N2+3H2 = 2NH3的能量变化如图所示,该反应的热化学方程式是:N2(g)+3H2(g) = 2NH3(l);⊿H =
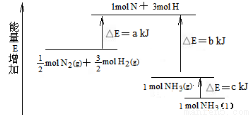
(2)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(3)已知:反应H2(g) + Cl2(g) = 2HCl(g) ΔH= —184 kJ/mol
4HCl(g)+O2(g) 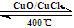 2Cl2(g)+2H2O(g) ΔH= —115.6 kJ/mol
2Cl2(g)+2H2O(g) ΔH= —115.6 kJ/mol

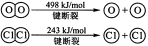
请回答:
H2与O2反应生成气态水的热化学方程式
断开1 mol H—O 键所需能量约为 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com