
| ||
| ||
| n |
| V |
| ||
| ||
| n |
| V |
| n |
| V |
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:山西省山大附中2011-2012学年高二5月月考化学试题 题型:058
Ⅰ.某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题.
(1)配制100 mL 1 mol/L的NH4Cl溶液.该同学应用托盘天平称量NH4Cl固体的质量为________g.
有以下仪器:烧杯、胶头滴管、玻璃棒等玻璃仪器.
①还缺少的仪器有________;
②使用容量瓶前必须进行的一步操作是________;
(2)该同学又用下图所示的装置做了有关氨气的性质实验.
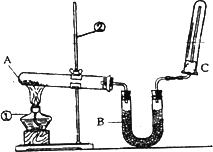
①写出实验室制氨气的化学方程式:________;
②写出B中盛放的是碱石灰其作用是________;
③氨气极易溶于水,在氨水中滴加酚酞现象是________;
④检验氨气的方法是________.
Ⅱ.在稀硝酸中放入足量的铜片:
(1)反应的化学方程式为________;
(2)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是________.(用离子方程式表示)
(3)若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况下).则所消耗的硝酸的物质的量是________.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省山大附中高二5月月考化学试卷(带解析) 题型:实验题
Ⅰ.(8分)某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题。
(1)配制100mL1mol/L的NH4Cl溶液。该同学应用托盘天平称量NH4Cl固体的质量为 g。
有以下仪器:烧杯、胶头滴管、玻璃棒等玻璃仪器。
①还缺少的仪器有 ;
②使用容量瓶前必须进行的一步操作是 ;
(2)该同学又用下图所示的装置做了有关氨气的性质实验。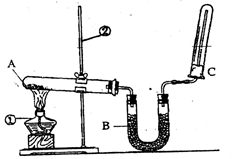
①写出实验室制氨气的化学方程式: ;
②写出B中盛放的是碱石灰其作用是 ;
③氨气极易溶于水,在氨水中滴加酚酞现象是 ;
④检验氨气的方法是 。
Ⅱ.(6分)在稀硝酸中放入足量的铜片:
(1)反应的化学方程式为 ;
(2)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是 。(用离子方程式表示)
(3)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6L(标
准状况下)。则所消耗的硝酸的物质的量是 。
查看答案和解析>>
科目:高中化学 来源:2013届山西省高二5月月考化学试卷(解析版) 题型:实验题
Ⅰ.(8分)某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题。
(1)配制100mL1mol/L的NH4Cl溶液。该同学应用托盘天平称量NH4Cl固体的质量为 g。
有以下仪器:烧杯、胶头滴管、玻璃棒等玻璃仪器。
①还缺少的仪器有 ;
②使用容量瓶前必须进行的一步操作是 ;
(2)该同学又用下图所示的装置做了有关氨气的性质实验。
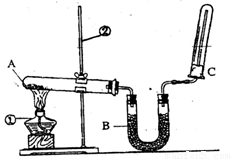
①写出实验室制氨气的化学方程式: ;
②写出B中盛放的是碱石灰其作用是 ;
③氨气极易溶于水,在氨水中滴加酚酞现象是 ;
④检验氨气的方法是 。
Ⅱ.(6分)在稀硝酸中放入足量的铜片:
(1)反应的化学方程式为 ;
(2)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是 。(用离子方程式表示)
(3)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6L(标
准状况下)。则所消耗的硝酸的物质的量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题。
(1)配制100mL1mol/L的NH4Cl溶液。该同学应用托盘天平称量NH4Cl固体的质量为 g。
有以下仪器:烧杯、胶头滴管、玻璃棒等玻璃仪器。
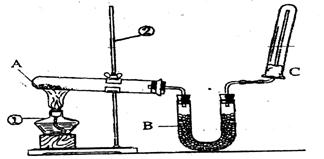 ①还缺少的仪器有 ;
①还缺少的仪器有 ;
②使用容量瓶前必须进行的一步操作是 ;
(2)该同学又用下图所示的装置做了有关氨气的性质实验。
①写出实验室制氨气的化学方程式: ;
②写出B中盛放的是碱石灰其作用是 ;
③氨气极易溶于水,在氨水中滴加酚酞现象是 ;
④检验氨气的方法是 。
Ⅱ.(6分)在稀硝酸中放入足量的铜片:
(1)反应的化学方程式为 ;
(2)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是 。(用离子方程式表示)
(3)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6L(标
准状况下)。则所消耗的硝酸的物质的量是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com