
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 强电解质都是离子化合物,而弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不同的弱电解质只要物质的量浓度相同,电离程度也相同 |
分析 A.溶液的导电能力与离子的浓度有关,与电解质的强弱无关;
B.有些强电解质为共价化合物,有些弱电解质为离子化合物;
C.根据强电解质的定义分析,强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物;
D.每一种弱电解质电离的程度各不相同,有本身的性质决定.
解答 解:A.溶液的导电能力与离子的浓度有关,浓度越大导电能力越强,浓度越小导电能力越弱.强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物,溶液的导电能力与电解质的强弱无关,如硫酸钡是强电解质,难溶于水,离子浓度小,导电能力弱,CH3COOH为弱电解质,易溶于水,当乙酸浓度比较大时,离子的浓度大,导电能力强,故A错误;
B.氯化氢为强电解质,但氯化氢为共价化合物,氢氧化铝为弱电解质,但它是离子化合物,故B错误;
C.强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物.即溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物,电解质的水溶液中不存在溶质分子,故C正确;
D.不同弱电解质电离程度由本性决定,浓度相同的弱电解质溶液中电离程度不一定相同,故D错误;
故选C.
点评 本题考查了导电能力大小与强弱电解质的关系,注意“导电能力大小与离子浓度有关,与电解质强弱无关”是解答本题的关键,题目较简单.


科目:高中化学 来源: 题型:多选题
 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )| A. | 该反应的正反应为放热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512K时,图中N点v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验目的 | T/K | 催化剂用量/g | c/mol•l-1 | |
| KMnO4 | H2C2O4 | ||||
| Ⅰ | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| Ⅱ | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| Ⅲ | 323 | 0.5 | 0.01 | 0.1 | |
| Ⅳ | 探究催化剂对反应速率的影响 | 0.1 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①④ | C. | ②③ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去产物只有1种 的消去产物只有1种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
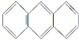 )和菲(
)和菲(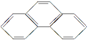 )都是比较简单的稠环芳香烃,有关它们的说法正确的是( )
)都是比较简单的稠环芳香烃,有关它们的说法正确的是( )| A. | 蒽和菲属于同系物 | |
| B. | 蒽和菲属于同分异构体 | |
| C. | 蒽的一氯代物有3种,而菲的一氯代物有5种 | |
| D. | 蒽和菲均可以看成是苯的同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com