
| A. | ①⑤ | B. | ② | C. | ①④ | D. | ①③⑤ |
分析 比较非金属性可通过以下角度:氢化物的稳定性;与氢气反应的难易程度;最高价氧化物对应的水化物的酸性;单质之间的置换反应;对应阴离子的还原性强弱;与变价金属反应的化合价高低等.
解答 解:①元素的非金属性越强,对应的氢化物越稳定,HCl比H2S稳定,Cl比S非金属性强,故①正确;
②比较非金属性的强弱,根据最高价含氧酸的氧化性强弱来比较,最高价含氧酸的酸性越强,则元素的非金属性越强,HClO不是最高价含氧酸,故②错误;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,HClO4酸性比H2SO4强,Cl比S非金属性强,故③正确;
④元素的非金属性越强,对应的单质的氧化性越强,Cl2能与H2S反应生成S,Cl比S非金属性强,故④正确;
⑤元素的非金属性越强,对应的单质的氧化性越强,Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,说明Cl2的氧化性大于S,则非金属性Cl大于S,故⑤正确;
故选B.
点评 本题考查非金属性的比较,学习中注意把握比较非金属性强弱的角度,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44g丙烷含有共价键的数目为9NA | |
| B. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA | |
| C. | 电解58.5g熔融的NaCl,能产生11.2L氯气、23.0g金属钠 | |
| D. | 1 L 1 mol.L-1的Na2CO3溶液中CO32-、HCO3-离子数目之和小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取12.5g胆矾配成500mL溶液 | B. | 称取8.0g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取7.68g硫酸铜,加入500mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g金刚石中含σ键数为4 NA | |
| B. | 1mol Na2O2固体中含离子总数为4 NA | |
| C. | ag C2H4和C3H6的混合物所含碳氢键数目为$\frac{a{N}_{A}}{14}$ | |
| D. | 30g甲醛中含π键数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
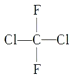 (商品名称为氟里昂-12,一种限制使用的制冷剂,类似于甲烷的结构)的叙述正确的是( )
(商品名称为氟里昂-12,一种限制使用的制冷剂,类似于甲烷的结构)的叙述正确的是( )| A. | 有两种同分异构体 | B. | 是烷烃 | ||
| C. | 只有一种结构 | D. | 有四种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2能与水反应,在反应中Cl2只能作氧化剂 | |
| B. | 氧化性Cl2>Br2>I2,还原性Cl->Br->I- | |
| C. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| D. | 氯水具有酸性,可用pH试纸测量其pH值 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:填空题
(1)可逆反应2Cl2(g)+2H2O(g  4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率___ _______;υ(逆)______________;
②保持容器体积不变,加入He,则HCl的物质的量__________。
③保持容器压强不变,加入He,则O2的物质的量__________;
④若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度 ____,相对分子质量_________。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+ 6C(s) + 2N2(g) Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)
①该反应的平衡常数表达式为 K= ;
②若知上述反应为吸热反应,升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);若已知CO生 成速率为υ(CO)=18mol·L-1·min-1,则N2消耗速率为υ(N2)= 。
成速率为υ(CO)=18mol·L-1·min-1,则N2消耗速率为υ(N2)= 。
③达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率υ与时间t的关系如下图。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。

查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:填空题
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等,氮、磷、砷位于同一主族,回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga As,第一电离能Ga As。(填“大于”或“小于”)
(3)氮原子的L层中有__________对成对电子,NH4+的立体构型是__________,其中心原子的杂化方式为__________;PCl3属于含有 键的 分子(填“极性”或“非极性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com