
| A、乙醇在浓硫酸存在下发生消去反应 |
| B、乙醇与金属钠反应 |
| C、乙醇的酯化反应 |
| D、乙醇在铜丝存在条件下发生催化氧化 |


科目:高中化学 来源: 题型:
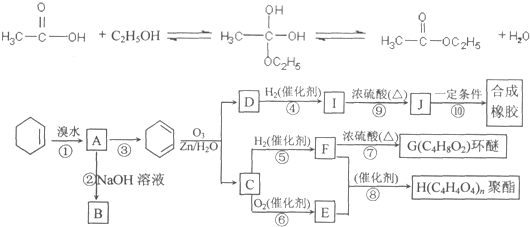
| O3,Zn/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体粒子直径在lnm~100nm |
| B、遇BaCl2溶液或Fe(OH)3胶体可发生聚沉 |
| C、电泳时,该胶体向阴极方向移动 |
| D、Na+使此胶体凝聚的效果不如Ca2+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
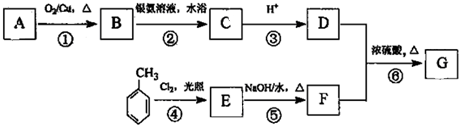
查看答案和解析>>
科目:高中化学 来源: 题型:
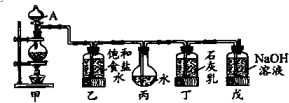
| 实验装置 | 实验现象 |
| 步骤1:将干燥的红布条投入到装有干燥氯气的集气瓶 | 发现有色布条不褪色 |
| 步骤2:将新制的饱和氨水等分成两份分装于A、B两试管 |  |
| 步骤3:向B中加入足量NaHCO3固体 |  |
| 步骤4:同时向A、B两试管加入相同大小的红布条,观察褪色的先后顺序 | B试管褪色所需时间短 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 名称 | 原理 |
| 方法一 | 尿素法 | 在温度70-95℃时,尿素溶液吸收NO、NO2,将其转化为N2 |
| 方法二 | 选择性催化还原( SCR)法 | 以NH3等作为还原剂,将烟气中的NOx还原生成N2和H2O |
| 方法三 | 电学法 | 以连二亚硫酸盐为氧化还原中介剂,将NOx还原为N2和N2O,连二亚硫酸盐被氧化成SO32-,经电化学还原而重复使用.采用内电池模式将SO2氧化为硫酸,在外电池模式时,电池可再生 |
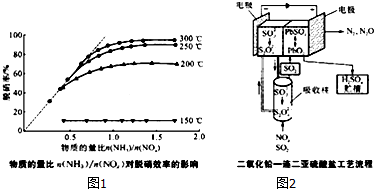
查看答案和解析>>
科目:高中化学 来源: 题型:
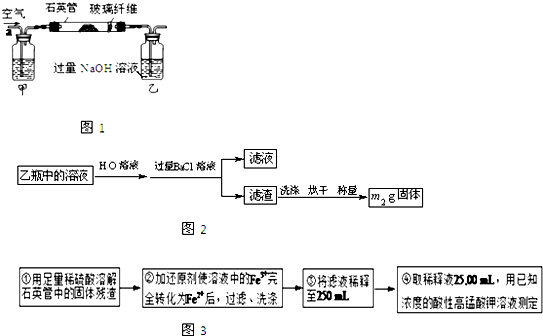
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
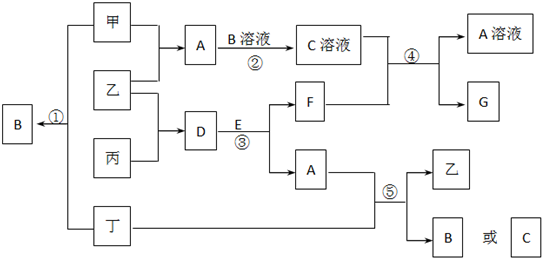
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com