
(1) 8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
|
化学键 |
H—H |
N—H |
N≡N |
|
键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
。
.(1)CH3OH(l)+3/2 O2(g)== CO2(g)+2H2O(l) ΔH=-4QKJ/mol
(2) -93。 (3)2C(s,石墨)+H2(g)=C2H2(g)
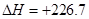 KJ/mol
KJ/mol
【解析】
试题解析:(1) 燃烧热是1 mol可燃物完全燃烧生成稳定氧化物释放的热量。8g CH3OH燃烧放热Q kJ,则1 molCH3OH完全燃烧放热4Q kJ.所以CH3OH(l)+ O2(g)== CO2(g)+2H2O(l) ΔH=-4QKJ/mol;
(2) ΔH=反应物的键能总和-生成物的键能总和=(945+3×436)kJ/mol -2×3×391 kJ/mol =-93 kJ/mol,即a=-93
(3) :C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol ①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol ③
由 (①×4+ ②-③)/2得
2C(s,石墨)+H2(g)=C2H2(g)
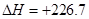 KJ/mol
KJ/mol
考点:盖斯定律的应用和热化学方程式的书写


科目:高中化学 来源: 题型:
| 元素 | 信息 |
| A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | B原子得一个电子后2p轨道全满 |
| C | C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大 |
| D | D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于其中子数 |
| E | E+和B-具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最 小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周 期;E元素原子的最外层电子数是其次外层电子数的
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最 小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周 期;E元素原子的最外层电子数是其次外层电子数的| 3 | 4 |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省常州市高二化学期末模测化学试卷一(解析版) 题型:填空题
(1)8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
|
化学键 |
H—H |
N—H |
N≡N |
|
键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com