
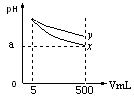
| A.稀释后x溶液中水的电离程度比y溶液中水电离程度小 |
| B.若x、y是一元碱,室温下pH=11的x、y两种碱溶液的浓度相同 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.中和两者,需要pH相等的相同体积的NaOH溶液 |
| B.稀释两者相同倍数时,pH仍然相等 |
| C.加适量的醋酸钠晶体后,两溶液的pH均增大 |
| D.加足量的锌充分反应后,两溶液中产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH4++NH2—电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
NH4++NH2—电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是| A.电离平衡常数是1×10-15 |
| B.不加入其他物质,液氨中c(NH4+)=c(NH2—) |
| C.降低温度,其电离平衡常数数值增加 |
| D.此液氨中放入NH4Cl,其电离平衡常数的数值增加 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
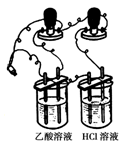
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
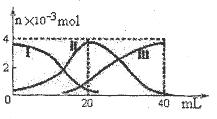
| A.当V(NaOH)=20mL时,溶液中离子浓度大小关系: C(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.HA-的电离程度小于水解程度 |
| C.滴加过程中当溶液呈中性时,V(NaOH)<20mL |
| D.当V(NaOH)=40mL时,向所得溶液加水稀释的过程中pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是( )
CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是( )| A.加入NaOH(s) | B.加入盐酸 | C.加蒸馏水 | D.升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com