
| A. | 标准状况下22.4 L的CCl4中含有NA个分子 | |
| B. | 1 mol Cl2溶于足量水中一定转移NA个电子 | |
| C. | 18 g 18O2和18O3中一共含有NA个18O原子 | |
| D. | 1 mol•L-1的NaOH溶液中共含有NA个Na+ |
分析 A、气体摩尔体积适用对象为气体;
B、氯气与水的反应为可逆反应;
C、根据18O2和18O3均由18O原子构成来计算;
D、溶液体积不知不能计算微粒数.
解答 解:A、标准状况下,CCl4为液体,不能使用气体摩尔体积,故A错误;
B、因为氯气与水的反应为可逆反应,可逆反应不能进行到底,所以反应中转移的电子数小于NA,故B错误;
C、18O2和18O3均由18O原子构成,18 g 18O2和18O3中含有的氧原子的物质的量n=$\frac{m}{M}$=$\frac{18g}{18g/mol}$=1mol,故含有原子数为NA,故C正确;
D、溶液体积不知不能计算微粒数,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-16Q kJ•mol-1 | |
| B. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-8Q kJ•mol-1 | |
| C. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-Q kJ•mol-1 | |
| D. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-Q kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3+3Cl2═N2+6HCl | B. | 2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$ N2+3Cu+3H2O | ||
| C. | Cl2+2NaOH═NaCl+NaClO+H2O | D. | KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E | F |
| 原子半径/nm | 0.186 | 0.143 | 0.160 | 0.102 | 0.074 | 0.099 |
| 主要化合价 | +l | +3 | +2 | +6、-2 | -2 | +7、-1 |
| A. | 元素D位于第三周期Ⅵ族 | |
| B. | A、B、C三种元素的最高价氧化物对应水化物的碱性依次增强 | |
| C. | 1mol F的单质参加氧化还原反应时转移的电子数一定为2 mol | |
| D. | 元素B、E形成的化合物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
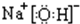
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的无色溶液:Al3+、Cu2+、SO42-、Cl- | |
| B. | 使酚酞试液变红的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 在c(H+)=l×l0-13mol•L-1的溶液中:NH4+、Ba2+、Cl-、NO3- | |
| D. | 含有0.lmol.L-1Fe3+的溶液中:H+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 min时:c(SO3)+c(SO2)=1.0mol/L | |
| B. | 2 min 内:v(SO2)=0.25mol/(L•min) | |
| C. | 若再充入2mol SO3,达平衡时SO3%(质量分数)减小 | |
| D. | 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0.75a kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com