
【题目】回答下列问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=179.5 kJ·mol-1
请写出CO和NO2生成N2、CO2的热化学方程式_________________________。
(2)亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g) ![]() 2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):
2C1NO(g),已知几种化学键的键能数据如下表(NO的结构为N≡O,亚硝酸氯的结构为Cl-N=O):
化学键 | N≡O | Cl- Cl | Cl-N | N=O |
键能/kJ·mol-1 | 630 | 243 | a | 607 |
则2NO(g)+C12(g) ![]() 2C1NO(g)反应的ΔH和a的关系为ΔH=________kJ·mol-1。
2C1NO(g)反应的ΔH和a的关系为ΔH=________kJ·mol-1。
【答案】4CO(g)+2NO2(g) =4CO2(g)+N2(g) ΔH=-1227.8 kJ·mol-1 289-2a
【解析】
(1) CO和NO2生成N2、CO2,要写其热化学方程式,可通过盖斯定律和
已知①、②和③这3个热化学方程式计算即可;
(2)2NO(g)+C12(g) ![]() 2C1NO(g)反应的焓变△H=反应物总键能-生成物总键能,据此计算ΔH即可;
2C1NO(g)反应的焓变△H=反应物总键能-生成物总键能,据此计算ΔH即可;
(1) CO和NO2生成N2、CO2,则4CO(g)+2NO2(g) =4CO2(g)+N2(g),已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=179.5 kJ·mol-1
按盖斯定律,②×4+①-③计算为可得:4CO(g)+2NO2(g) =4CO2(g)+N2(g),则该反应的焓变ΔH=(-234kJmol-1)×4+(-112.3kJmol-1)-(+179.5kJmol-1)=-1227.8kJmol-1,则3个热化学方程式为:4CO(g)+2NO2(g) =4CO2(g)+N2(g) ΔH=-1227.8 kJ·mol-1;
答案为:4CO(g)+2NO2(g) =4CO2(g)+N2(g) ΔH=-1227.8 kJ·mol-1;
(2)2NO(g)+C12(g) ![]() 2C1NO(g)反应的焓变△H=反应物总键能-生成物总键能,据此计算ΔH =2×(630kJ/mol)+(243kJ/mol)-2[akJ/mol+(607kJ/mol)]=(289-2a)kJ/mol;
2C1NO(g)反应的焓变△H=反应物总键能-生成物总键能,据此计算ΔH =2×(630kJ/mol)+(243kJ/mol)-2[akJ/mol+(607kJ/mol)]=(289-2a)kJ/mol;
答案为:289-2a。


科目:高中化学 来源: 题型:
【题目】下图为几种晶体或晶胞的示意图:
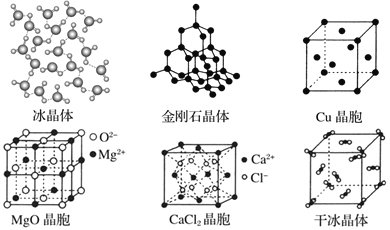
请回答下列问题:
(1)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_____。
(2)MgO晶体中,距每个O2-最近且距离相等的O2-有_____个。
(3)每个Cu晶胞中实际占有_____个Cu原子;CaCl2晶体中Ca2+的配位数为_____。
(4)冰的熔点远高于干冰,除 H2O 是极性分子、CO2 是非极性分子外, 还有一个重要的原因是____。
(5)金刚石晶胞含有_________个碳原子;若碳原子半径为 r,根据硬球接触模型,列式表示碳原子在晶胞中的空间占有率_____(计算结果为含π的分数,不要化为小数或百分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系。已知在常温常压下,A是固体,B、C、D、E是非金属单质且都是气体,C呈黄绿色;化合物F是淡黄色固体,化合物G的焰色反应为黄色,化合物Ⅰ和J通常状况下呈气态;D和E反应生成一种刺激性气味的气体。
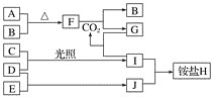
请回答下列问题:
(1)E和J的化学式分别是________和________。
(2)写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况:_________。
(3)将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为_________。
(4)标况下3.36 L气体B与A完全反应,转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某有机物分子X的球棍模型(图中不同的小球分别代表C、H、O三种原子;球与球之间的短线代表化学键,如单键或双键等)。下列说法中正确的是()
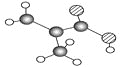
A.X属于羧酸,是乙酸的同系物
B.X可以发生加成反应和取代反应
C.与X含有相同官能团的结构还有1种
D.X分子中的4个碳原子,肯定不在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,下列说法正确的是
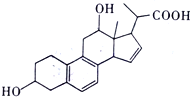
A. 该有机物的分子式为C21H24O4
B. 该有机物共有四种官能团,分别是:羟基、羧基、苯环、碳碳双键
C. 该有机物最多消耗NaOH与NaHCO3的物质的量比为1:1
D. 1mol 该有机物与足量金属钠反应,生成33.6L氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-==Fe(OH)3↓+BaSO4↓
D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。CO和H2在催化剂作用下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入2.4 mol CO和2 mol H2,达到平衡时容器体积为4 L,且含有0.8 mol CH3OH(g),写出必要的计算过程进行计算:
CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入2.4 mol CO和2 mol H2,达到平衡时容器体积为4 L,且含有0.8 mol CH3OH(g),写出必要的计算过程进行计算:
(1)该反应的化学平衡常数_____________________。
(2)此时向容器中再通入0.7 mol CO气体,判断平衡移动的方向________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出铝丝与硫酸铜溶液的化学方程式,并用双线桥标出电子的转移。化学方程式: _______________;氧化剂:__________ ,还原剂: __________,氧化产物:___________ ,还原产物:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用氯氧化法处理含氰(![]() )废水,一定条件下,氯气和
)废水,一定条件下,氯气和![]() 反应生成无毒气体。下列说法不正确的是
反应生成无毒气体。下列说法不正确的是
A. ![]() 中碳元素的化合价为+2
中碳元素的化合价为+2
B. 该反应的产物之一是无毒的![]()
C. 当1mol![]() 参与反应时,转移
参与反应时,转移![]()
D. 处理含0.1mol![]() 的废水,理论上需要消耗标准状况下
的废水,理论上需要消耗标准状况下![]() 的体积为5.6L
的体积为5.6L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com