
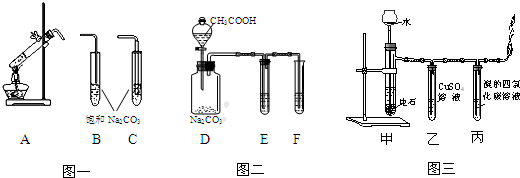
分析 (1)图一A中乙酸和乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯和水;为了避免发生倒吸现象,吸收乙酸乙酯的导管不能伸入溶液中;
(2)图二是验证醋酸、碳酸、苯酚酸性强弱,醋酸具有挥发性,应该在E中用碳酸氢钠溶液除去挥发出来的醋酸,通过二氧化碳气体与苯溶液的反应证明碳酸的酸性大于苯酚;
(3)制取的乙炔中混有的硫化氢、磷化氢等杂质会对乙炔的检验产生干扰,需要用硫酸铜溶液除去;制取乙炔通常用饱和食盐水和电石反应,若用水与电石直接反应会使产生的乙炔的速率较快.
解答 解:(1)图一中A发生酯化反应,反应的化学方程式为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;吸收乙酸乙酯的导管不能伸入溶液中,否则容易发生倒吸现象,所以A导管应该与B连接,
故答案为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;B;
(2)图二的实验目的是验证醋酸、碳酸、苯酚酸性强弱,通过醋酸与碳酸钠溶液的反应证明醋酸的酸性大于碳酸,通过二氧化碳与苯酚钠的反应证明碳酸的酸性大于苯酚,由于醋酸具有挥发性,D中生成的二氧化碳中混有醋酸,需要用碳酸氢钠溶液除去,所以D盛放C.碳酸氢钠溶液,E盛放B.苯酚钠溶液,
故答案为:C;B;
(3)电石与水反应生成的乙炔气体中混有H2S和PH3等杂质,H2S和PH3等杂质会影响丙中乙炔性质的检验,需要先用硫酸铜溶液除去;实验室中制取乙炔用饱和食盐水和电石反应,可以减小反应速率,若直接用水与电石反应,会导致反应速率较快,
故答案为:除去乙炔中H2S和PH3等杂质;直接用水与电石反应,导致生成气体的速度很快.
点评 本题考查了乙酸乙酯的制取、酸性强弱比较、乙炔的制取等知识,题目难度中等,注意掌握常见物质的制备原理及装置特点,试题侧重考查学生的分析能力及化学实验能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
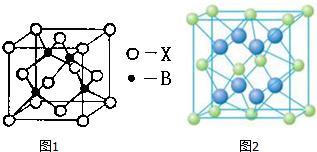
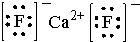 .则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.
.则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
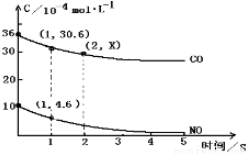
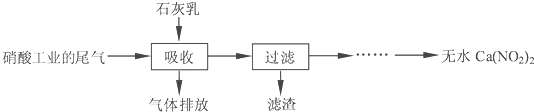
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④③① | B. | ②③① | C. | ②④③⑤① | D. | ②⑤③① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的状态与反应热有关 | B. | 物质的状态与生成物有关 | ||
| C. | 可以具体说明反应进行的情况 | D. | 可以具体说明反应发生的条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com