
| A. | 常温下,用pH计测量0.1mol•L-1FeCl3溶液的pH为a,再测量稀释10倍的0.01mol•L-1FeCl3溶液的pH为b,可判断出FeCl3水解程度与盐溶液浓度大小关系 | |
| B. | 将装有3~4mL无水乙醇的试管浸入50℃左右的热水中,将烧黑的铜丝迅速插入无水乙醇中,可观察到铜丝变红,反复数次,可闻到刺激性气味 | |
| C. | 向某溶液加浓NaOH溶液并微热,若产生的气体能使湿润的红色石蕊试纸变蓝,则说明此溶质为铵盐 | |
| D. | 酸碱中和滴定到终点读数时,发现滴定管尖嘴处悬挂一滴标准溶液,导致实验结果偏高 |
分析 A.稀释促进水解,氢离子的物质的量增大,浓度减小,则稀释前后的pH不同;
B.乙醇被CuO氧化生成乙醛;
C.检验氨气,利用红色石蕊试纸,原溶液可能为铵盐或氨水;
D.发现滴定管尖嘴处悬挂一滴标准溶液,消耗的标准液体积偏大.
解答 解:A.稀释促进水解,氢离子的物质的量增大,浓度减小,则稀释前后的pH不同,则用pH计测量pH可判断出FeCl3水解程度与盐溶液浓度大小关系,故A正确;
B.乙醇被CuO氧化生成乙醛,则可观察到铜丝变红,反复数次,可闻到刺激性气味,故B正确;
C.检验氨气,利用红色石蕊试纸,原溶液可能为铵盐或氨水,则溶质不一定为铵盐,故C错误;
D.发现滴定管尖嘴处悬挂一滴标准溶液,消耗的标准液体积偏大,则导致实验结果偏高,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,注意化学反应原理与实验的结合及实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
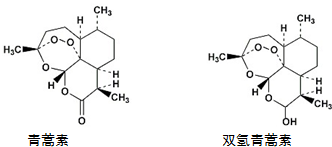
| A. | 青蒿素能发生还原反应 | |
| B. | 双氢青蒿素发生酯化反应和氧化反应 | |
| C. | 青蒿素分子中含有过氧键和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
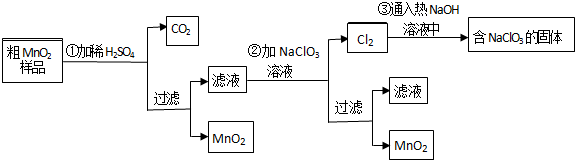
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7,且c(Na +)>c(OH -)>c(H +)>c(CH3COO-) | |
| B. | pH>7,且c(Na +)+c(H+)=c(CH3COO -)+c(OH-) | |
| C. | PH<7,且c(CH3COO -)>c(H+)>c(Na+)>c(OH-) | |
| D. | pH=7,且c(CH3COO -)=c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
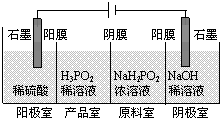 次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
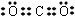 ;
;查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.铜和醋酸反应:Cu+2CH3COOH 2CH3COO-+Cu2++H2↑
2CH3COO-+Cu2++H2↑
B.氧化铁与稀盐酸反应:Fe2O3+6H+ 2Fe3++3H2O
2Fe3++3H2O
C.锌与硝酸银溶液反应:Zn+Ag+ Zn2++Ag
Zn2++Ag
D.稀硝酸和石灰乳反应:H++OH- H2O
H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com