
【题目】下列反应中,氧化剂与还原剂物质的量的关系不是1∶2的是
A.O3+2KI+H2O===2KOH+I2+O2
B.3NO2+H2O===2HNO3+NO
C.3S+6NaOH===Na2SO3+2Na2S+3H2O
D.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【答案】C
【解析】
氧化还原反应中化合价降低得电子的物质为氧化剂,化合价升高失电子的是还原剂,结合方程式判断。
A.O3+2KI+H2O═2KOH+I2+O2,反应中O3为氧化剂,KI为还原剂,则氧化剂与还原剂物质的量之比为1:2,故A不选;
B.3NO2+H2O═2HNO3+NO,反应中1molNO2得电子为氧化剂,2molNO2失电子为还原剂,则氧化剂与还原剂物质的量之比为1:2,故B不选;
C.3S+6NaOH═Na2SO3+2Na2S+3H2O反应中2molS得电子为氧化剂,1molS失电子为还原剂,则氧化剂与还原剂物质的量之比为2:1,故C选;
D.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O,反应中1molMnO2得电子为氧化剂,2molHCl失电子为还原剂,则氧化剂与还原剂物质的量之比为1:2,故D不选;
MnCl2+Cl2↑+2H2O,反应中1molMnO2得电子为氧化剂,2molHCl失电子为还原剂,则氧化剂与还原剂物质的量之比为1:2,故D不选;
答案选C。


科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
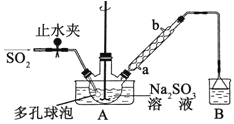
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,搅拌(防止生成沉淀覆盖在锌粉表面阻止反应进行),反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
⑴装置B 的烧杯中应加入的溶液是__________________________________________。
⑵A中多孔球泡的作用是_______________________________________________。
⑶冷凝管中回流的主要物质除H2O 外还有__________________________(填化学式)。
⑷写出步骤2中发生反应的化学方程式____________________________。
⑸步骤3中在真空容器中蒸发浓缩的原因是__________________________________。
⑹①抽滤时使用如下装置,其中a和b的名称分别__________、 __________。中途停止抽滤时应 ___________________________以防倒吸。
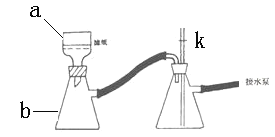
②如果抽滤的溶液具有强氧化性时,可采取_________________________________的措施
⑺为了测定产品的纯度,准确称取2.000g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.利用浓硝酸与蛋白质的颜色反应,可鉴别含有苯环的蛋白质
B.用新制氢氧化铜可以鉴别丙三醇、丙醛、丙酸
C.甘氨酸可以以![]() 的形式从水溶液中结晶析出
的形式从水溶液中结晶析出
D.除去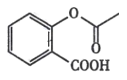 中的杂质
中的杂质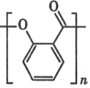 :加足量饱和NaHCO3溶液 ,过滤
:加足量饱和NaHCO3溶液 ,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.治疗胃酸过多的药物达喜(其式量不超过 700)由五种短周期元素组成,按如下流程进行实验以确定其组成。
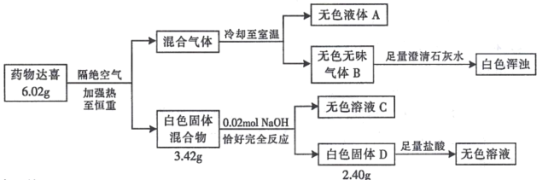
请回答:
(1)达喜的化学式是_____________。
(2)达喜与胃酸(含稀盐酸)反应的化学方程式是____________。
(3)气体 B 与环氧丙烷(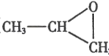 )可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
)可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
II.将 NaC1O3 溶液逐滴加入到碘单质和过量盐酸的混合液中可制备液态 ICl,实验装置如下图:
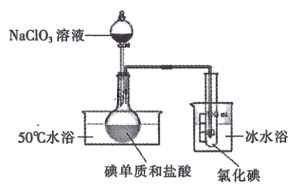
请回答:
(1)圆底烧瓶中发生的化学反应是______________( 用化学方程式表示)。
(2)若加入的 NaClO3 溶液已足量,请设计实验方案证明该反应已完全:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用Cl-取代[Co(NH3)6]3+离子中的NH3方法,制备配合物X:[Co(NH3)5Cl]Cl2。实验过程如下:
CoCl2﹒6H2O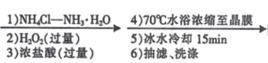 [Co(NH3)5Cl]Cl2晶体
[Co(NH3)5Cl]Cl2晶体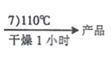
已知:
a.配合物X 能溶于水,且溶解度随温度升高而增大。
b.[Co( NH3)5Cl]2+离子较稳定,但加碱再煮沸可促进其解离:[Co(NH3)5Cl]2+![]() Co3++5NH3+Cl。
Co3++5NH3+Cl。
c.H2O2参与反应时,明显放热。
请回答:
(1)制备配合物X的总反应方程式为___________。
(2)“1) NH4Cl-NH3H2O”时,如果不加NH4Cl固体,对制备过程的不利影响是____。
(3)“2)H2O2”加H2O2 时应选择 _________(填序号)。
A.冷水浴 B.温水浴( ≈60°C)
C.沸水浴 D.酒精灯直接加热
(4)本实验条件下,下列物质均可将 Co(II)氧化为 Co(III)。其中可替代“2)H2O2”的是_____________(填序号)。
A.O2 B.KMnO4 溶液 C.Cl2 D.HNO3
(5)实验小组用以下思路验证配合物 X 的组成:取一定量 X 加入过量浓 NaOH 溶液,煮沸,将生成的NH3 通入一定量的稀硫酸中,再用NaOH 标准溶液滴定剩余 H2SO4 。从以下涉及碱式滴定管的操作中,选择正确操作并排序(润洗只操作一次即可):

检漏→水洗→加标准液,润洗内壁→___________→_________→_________→_________→……
a.从上口倒出润洗液
b.保持滴定管夹水平,平视滴定管刻度读数
c.装标准溶液,调液面,静置半分钟
d.滴定
e.取下滴定管,竖直,平视滴定管刻度读数
f.从下口放出润洗液
(6)下列关于实验过程的叙述,正确的是_____________(填序号)。
A.“4)70℃”水浴加热,有利于获得颗粒较大的晶体
B.抽滤后,应该用热水洗涤晶体
C.可用 AgNO3和稀HNO3 检验配合物X 是否已经洗净
D.抽滤结束,可先打开活塞K,再关掉抽气泵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
①已知KBrO3在反应中得到电子,则该反应的还原剂是____________________
②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为_____________
③根据上述反应可推知_______
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4> KBrO3
c.还原性:AsH3>X d.还原性:X > AsH3
(2)①向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+,该反应常用于检验Mn2+的存在。其特征现象是_________________,若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为__________
②将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:NaBiO3+MnSO4+H2SO4→Na2SO4+Bi2(SO4)3+NaMnO4+H2O,配平上述反应的化学方程式,并用双线桥标出电子转移的方向和数目__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是1mol金属镁和卤素反应的ΔH(单位:kJ·molˉ1)示意图,反应物和生成物均为常温时的稳定状态。下列选项中不正确的是
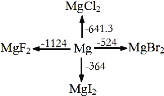
A.电解MgCl2制Mg是吸热反应
B.MgBr2与Cl2反应的ΔH<0
C.MgF2(s)+Br2(l) = MgBr2(s)+F2(g) ΔH=+600kJ·molˉ1
D.化合物的热稳定性顺序:MgI2>MgBr2>MgCl2>MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
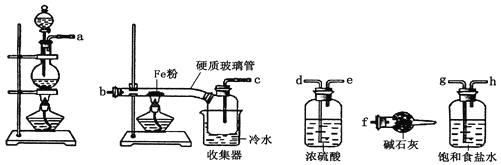
(1) 装置的连接顺序为a→_____→____→____→____→b→c→f。
(2) 硬质玻璃管中可观察到的现象是___________________;硬质玻璃管与收集器之间没有用导管连接,原因是____________________;反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

(3) 试剂X的化学式为___________;有同学分析淡黄色溶液中含有Fe2+,你认为_______(填“合理”或“不合理”);固体产物的成分可能为__________(填相应的字母);
A Fe和FeCl3 B FeCl2和FeCl3 C Fe、FeCl2和FeCl3 D Fe和FeCl2
(4) 加入少许植物油的作用是___________________,用离子方程式表示加入新制氯水后溶液红色加深的原因_______________________________。
(5) 某小组同学实验时在加入新制氯水后,并未得到深红色溶液,请帮助他们分析原因________,请设计实验对你所分析的原因进行验证,简要写出实验方案___________
(6)Cl2是一种黄绿色有刺激性气味的气体,实验室通常用NaOH溶液来吸收Cl2,以减少环境污染。若实验时需要450mL 4mol/L的NaOH溶液,则配制时,需要用托盘天平称取NaOH的质量为_______g,所使用的仪器除托盘天平、胶头滴管、玻璃棒外,还必须有_________。配制该溶液时,下列操作会使溶液浓度偏高的是___________。(填字母)
A 称量固体时动作缓慢 B 容量瓶未干燥立即用来配制溶液
C NaOH固体溶解后立刻转移 D 在容量瓶中定容时俯视容量瓶刻度线
E 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com