
ЎѕМвДїЎїПВБРАлЧУ·ЅіМКЅКйРґХэИ·µДКЗЈЁ Ј©
AЈ®ФЪ100 mLЕЁ¶ИОЄ1 molL©Ѓ1µД FeЈЁNO3Ј©3µДИЬТєЦРНЁИлЧгБїSO2Јє2Fe3++SO2+2H2OЁT2Fe2++SO42©Ѓ+4H+
BЈ®ФЪ100 mLЕЁ¶ИОЄ2 molL©Ѓ1µДFeI2µДИЬТєЦРНЁИл±кЧјЧґїцПВ5.6 LµДCl2Јє4Fe2++6I©Ѓ+5Cl2ЁT4Fe3++3I2+10Cl©Ѓ
CЈ®ПтNaHCO3ИЬТєЦРјУИл№эБїµДіОЗеКЇ»ТЛ®Јє2HCO3©Ѓ+Ca2++2OH©ЃЁTCaCO3Ўэ+2H2O+CO32©Ѓ
DЈ®ПтГч·ЇИЬТєЦРјУИл№эБїµДЗвСх»Ї±µИЬТєЈєAl3++2SO42©Ѓ+2Ba2++4OH©ЃЁT2BaSO4Ўэ+AlO2©Ѓ+2H2O
Ўѕґр°ёЎїD
ЎѕЅвОцЎїЅвЈєAЈ®ФЪ100 mLЕЁ¶ИОЄ1 molL©Ѓ1µД FeЈЁNO3Ј©3µДИЬТєЦРНЁИлЧгБїSO2Ј¬ПхЛбёщАлЧУТІІОУл·ґУ¦Ј¬ХэИ·µДАлЧУ·ЅіМКЅОЄЈє3NO3©Ѓ+Fe3++5SO2+4H2OЁTFe2++5SO42©Ѓ+8H++3NOЎьЈ¬№КAґнОуЈ»
BЈ®ФЪ100 mLЕЁ¶ИОЄ2 molL©Ѓ1µДFeI2µДИЬТєЦРНЁИл±кЧјЧґїцПВ5.6 LµДCl2Ј¬ВИЖшµДОпЦКµДБїОЄЈє![]() =0.25molЈ¬µв»ЇСЗМъµДОпЦКµДБїОЄ0.2molЈ¬µвАлЧУ»№ФРФґуУЪСЗМъАлЧУЈ¬ФтµвАлЧУУЕПИ·ґУ¦Ј¬0.4molµвАлЧУНкИ«·ґУ¦ПыєД0.2molВИЖшЈ¬ЛµГчВИЖшЗЎєГ·ґУ¦Ј¬ХэИ·µД·ґУ¦ОЄЈє2I©Ѓ+Cl2ЁTI2+2Cl©ЃЈ¬№КBґнОуЈ»
=0.25molЈ¬µв»ЇСЗМъµДОпЦКµДБїОЄ0.2molЈ¬µвАлЧУ»№ФРФґуУЪСЗМъАлЧУЈ¬ФтµвАлЧУУЕПИ·ґУ¦Ј¬0.4molµвАлЧУНкИ«·ґУ¦ПыєД0.2molВИЖшЈ¬ЛµГчВИЖшЗЎєГ·ґУ¦Ј¬ХэИ·µД·ґУ¦ОЄЈє2I©Ѓ+Cl2ЁTI2+2Cl©ЃЈ¬№КBґнОуЈ»
CЈ®NaHCO3ИЬТєЦРјУИл№эБїµДіОЗеКЇ»ТЛ®Ј¬·ґУ¦ЙъіЙМјЛбёЖіБµнЎўЗвСх»ЇДЖєНЛ®Ј¬ХэИ·µДАлЧУ·ЅіМКЅОЄЈєHCO3©Ѓ+Ca2++OH©ЃЁTCaCO3Ўэ+H2OЈ¬№КCґнОуЈ»
DЈ®Гч·ЇИЬТєЦРјУИл№эБїµДЗвСх»Ї±µИЬТєЈ¬·ґУ¦µДАлЧУ·ЅіМКЅОЄЈєAl3++2SO42©Ѓ+2Ba2++4OH©ЃЁT2BaSO4Ўэ+AlO2©Ѓ+2H2OЈ¬№КDХэИ·Ј»
№КСЎDЈ®



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї»ЇС§ФЪЙъІъЎўЙъ»оЦРУР№г·єУ¦УГЈ¬ПВБР¶ФУ¦№ШПµХэИ·µДКЗ
СЎПо | »ЇС§РФЦК | КµјКУ¦УГ |
A | МјФЄЛШµД·ЗЅрКфРФ±И№иЗї | КЇУўєНМј·ЫµД»мєПОпёЯОВПВ·ґУ¦ЦЖ±ёґЦ№и |
B | ТТґјДЬК№µ°°ЧЦК±дРФ | ОЮЛ®ТТґјЧчТЅУГПы¶ѕјБ |
C | Гч·ЇИЬТєПФЛбРФ | Гч·ЇЧчѕ»Л®јБ |
D | УНЦ¬ФЪјоРФМхјюПВЛ®Ѕв | ИИµДNaOHИЬТєјш±рЦІОпУНєНїуОпУН |
A. A B. B C. C D. D
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї»ЇС§ІДБПФЪЙъ»оЦРУ¦УГ№г·єЎЈПВБРІДБПЦЖіЙµДОпЖ·ДСЅµЅвµДКЗ
A. ДѕІДФмµДЦЅХЕ B. ѕЫВИТТП©ЦЖµДµз»°їЁ
C. µн·ЫЧцµДµШД¤ D. ІПЛїЦЇµДЅх¶Р
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї25ЎжК±Ј¬Ѕ«pH=3µДЗїЛбИЬТєєНpH=12µДЗїјоИЬТє»мєПЈ¬µ±»мєПєуИЬТєµДpH=11К±Ј¬ЗїЛбєНЗїјоИЬТєµДМе»э±ИКЗ
A. 9:2 B. 9:1 C. 1:10 D. 2:5
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДіµШ»·±ЈІїГЕИЎТ»¶ЁБїДі№¤і§ЛщЕЕ·ПЛ®КФСщ·ЦіЙјЧЎўТТЎў±ыЎў¶ЎЛД·ЭЈ¬ЅшРРИзНјЛщКѕМЅѕїЈ®

ТСЦЄ·ПЛ®КФСщЦРїЙДЬє¬УРПВ±нЦРµДАлЧУЈє
СфАлЧУ | Na+ЎўMg2+ЎўX |
ТхАлЧУ | Cl©ЃЎўSO32©ЃЎўYЎўNO3©Ѓ |
ЈЁ1Ј©АлЧУXКЗ ЈЁМо»ЇС§КЅЈ¬ПВН¬Ј©Ј¬АлЧУYКЗ Ј®
ЈЁ2Ј©±нЦРІ»ДЬИ·¶ЁКЗ·сґжФЪµДТхАлЧУКЗ Ј¬ДЬЦ¤ГчёГТхАлЧУКЗ·сґжФЪµДјтµҐКµСйІЩЧчОЄ Ј®
ЈЁ3Ј©¶ЎЧйКµСйФЪЛбРФМхјюПВ·ўЙъ·ґУ¦µДАлЧУ·ЅіМКЅКЗ Ј®
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї№эМјЛбДЖ(2Na2CO33H2O2)КЗУЙNa2CO3УлH2O2ёґєП¶шРОіЙµДТ»ЦЦ№ММе·ЕСхјБЈ¬Н¬К±ѕЯУРNa2CO3єНH2O2Л«ЦШРФЦКЎЈїЙУГУЪПґµУЎў·ДЦЇЎўТЅТ©ЎўОАЙъµИБмУтЈ®№¤ТµЙПіЈТФ№эМјЛбДЖІъЖ·ЦР»оРФСхє¬Бї([O]%= ![]() ЎБ100АґєвБїЖдУЕБУЈ¬13%ТФЙПОЄУЕµИЖ·ЎЈТ»ЦЦЦЖ±ё№эМјЛбДЖµД№¤ТХБчіМИзНјЈє
ЎБ100АґєвБїЖдУЕБУЈ¬13%ТФЙПОЄУЕµИЖ·ЎЈТ»ЦЦЦЖ±ё№эМјЛбДЖµД№¤ТХБчіМИзНјЈє
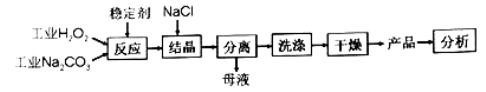
»ШґрПВБРОКМвЈє
ЈЁ1Ј©№эМјЛбДЖКЬИИТЧ·ЦЅвЈ¬Рґіц·ґУ¦µД»ЇС§·ЅіМКЅ_____________________Ј®
ЈЁ2Ј©ОИ¶ЁјБј°·ґУ¦ОВ¶ИµИТтЛШ¶ФІъЖ·ЦКБїУРєЬґуУ°ПмЈ®
ўЩПВБРКФјБЦРЈ¬їЙДЬУГЧчЎ°ОИ¶ЁјБЎ±µДКЗ__________(МоЧЦДё)Ј®
aЈ®MnO2 bЈ®KI cЈ®Na2SiO3 dЈ®FeCl3
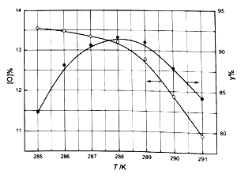
ўЪ·ґУ¦ОВ¶И¶ФІъЖ·ІъВК(y%)ј°»оРФСхє¬БїµДУ°ПмИзПВНјЛщКѕЈ®ТЄК№ІъЖ·ґпµЅУЕµИЖ·ЗТІъВКі¬№э90%єПККµД·ґУ¦ОВ¶И·¶О§КЗ_______________Ј®
ўЫЎ°Ѕбѕ§Ў±К±јУИлNaClµДДїµДКЗ____________ Ј®
ЈЁ3Ј©Ў°ДёТєЎ±ЦРїЙС»·АыУГµДЦчТЄОпЦККЗ____________________Ј®
ЈЁ4Ј©ІъЖ·ЦР»оРФСхє¬БїµДІв¶Ё·Ѕ·ЁЈєіЖБї0.1600gСщЖ·Ј¬ФЪ250mLЧ¶РОЖїЦРУГ100mL 0.5molL-1БтЛбИЬЅвНкИ«Ј¬БўјґУГ0.02000molL-1ёЯГМЛбјШ±кЧјИЬТєµО¶ЁЈ¬ЦБИЬТєіКЗіємЙ«ЗТ°л·ЦЦУДЪІ»НКЙ«јґОЄЦХµгЈ¬ЖЅРРИэґОЈ¬ПыєДKMnO4ИЬТєµДЖЅѕщМе»эОЄ26.56mLЎЈБнНвЈ¬ФЪІ»јУСщЖ·µДЗйїцПВ°ґХХЙПКц№эіМЅшРРїХ°ЧКµСйЈ¬ПыєДKMn04ИЬТєµДЖЅѕщМе»эОЄ2.24mLЈ®
ўЩ№эМјЛбДЖУлБтЛб·ґУ¦Ј¬ІъОпіэБтЛбДЖєНЛ®НвЈ¬»№УР_______________Ј®
ўЪІв¶ЁК±Ј¬ИфУГ№¤ТµСОЛбґъМжБтЛбЈ¬·ЦОц¶ФІв¶ЁЅб№ыµДУ°Пм (МоЎ°Ж«ґуЎ±ЎўЎ°Ж«РЎЎ±»тЎ°І»±дЎ±)ј°ЖдФТт____________Ј®
ўЫёГСщЖ·µД»оРФСхє¬БїОЄ__________% ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРОпЦКµДЧЄ»ЇФЪёш¶ЁМхјюПВДЬКµПЦµДКЗЈЁ Ј©
AЈ®H2SO4ЈЁПЎЈ©![]() SO2
SO2![]() NH4HSO3
NH4HSO3![]() ЈЁNH4Ј©2SO3
ЈЁNH4Ј©2SO3
BЈ®NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
CЈ®Fe![]() FeCl2
FeCl2![]() FeЈЁOHЈ©2
FeЈЁOHЈ©2![]() FeЈЁOHЈ©3
FeЈЁOHЈ©3
DЈ®Al![]() NaAlO2
NaAlO2![]() AlCl3ИЬТє
AlCl3ИЬТє![]() ОЮЛ®AlCl3
ОЮЛ®AlCl3
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїёщѕЭНјКѕМоїХЈ®
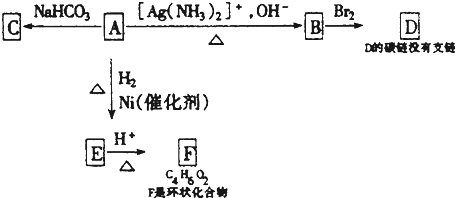
ЈЁ1Ј©1mol AУл2mol H2·ґУ¦ЙъіЙ1mol EЈ¬Жд·ґУ¦·ЅіМКЅКЗ Ј®
ЈЁ2Ј©УлAѕЯУРПаН¬№ЩДЬНЕµДAµДН¬·ЦТм№№МеµДЅб№№јтКЅКЗ Ј®
ЈЁ3Ј©BФЪЛбРФМхјюПВУлBr2·ґУ¦µГµЅDЈ¬DµДЅб№№јтКЅКЗ Ј®
ЈЁ4Ј©FµДЅб№№јтКЅКЗ Ј®УЙEЙъіЙFµД·ґУ¦АаРНКЗ Ј®
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїУГИзНјЧ°ЦГІв¶ЁЛ®ЦРЗвЎўСхФЄЛШµДЦКБї±ИЈ¬Жд·Ѕ·ЁКЗ·Ц±рІв¶ЁНЁЗвЖшЗ°єуІЈБ§№ЬµДЦКБїІоєНUРО№ЬµДЦКБїІоЈ¬КµСйІвµГm(H)ЎГm(O)Јѕ1ЎГ8ЎЈПВБР¶ФµјЦВХвТ»Ѕб№ыµДФТтµД·ЦОцЦРЈ¬Т»¶ЁґнОуµДКЗ
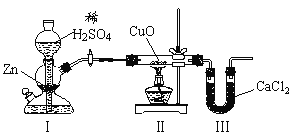
AЈ®ўсЎўўтЧ°ЦГЦ®јдИ±ЙЩёЙФпЧ°ЦГ
BЈ®ўуЧ°ЦГєуИ±ЙЩёЙФпЧ°ЦГ
CЈ®ўтЧ°ЦГЦРІЈБ§№ЬДЪУРЛ®АдДэ
DЈ® CuOГ»УРИ«Ії±»»№Ф
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com