
为提高生活用水的卫生标准,自来水厂常同时使用氯气和绿矾(FeSO4×7H2O)进行消毒、净化以改善水质,结合有关反应的化学方程式(或离子方程式)说明其原理__________。
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:阅读理解
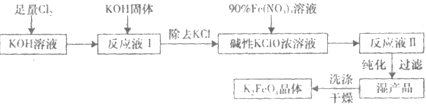
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)为了延长液氯杀菌时间,某些自来水厂在用液氯进行消毒处理时,还加入少量液氨,其反应的化学方程式为:NH3+HClO![]() H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。
H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质,其原因是_____________________________。
(2)为了延长液氯杀菌时间,某些自来水厂在用液氯进行消毒处理时,还加入少量液氨,其反应的化学方程式为:NH3+HClO![]() H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。
H2O+NH2Cl(一氯氨)。已知NH2Cl比HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com