
【题目】下面是关于细胞中水和无机盐的叙述,其中正确的是
A. 越冬植物的细胞内自由水含量较高
B. 不同细胞内自由水与结合水的比例基本相同
C. 急性肠炎病人除补水外还需要补充一些无机盐
D. 营养性贫血患者体内肯定缺乏Ca2+
科目:高中化学 来源: 题型:
【题目】I.A~D是四种烃分子的球棍模型(如图)
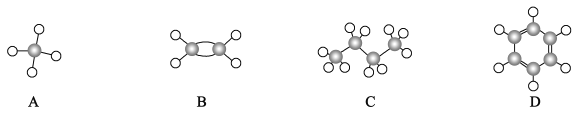
(1)所有原子一定共平面的是______(填序号)
(2)能使酸性高锰酸钾溶液褪色的物质是_____ (填序号)
(3)D与浓硝酸和浓硫酸共热的化学方程式______。
II.某些有机物的转化如下图所示。已知:A是营养物质之一,米饭、馒头中富含A,在酸性条件下水解的最终产物是B。C是白酒的主要成分,D的水溶液能使紫色石蕊试液变红。
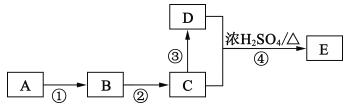
(4)C中官能团的名称为______;反应③的反应类型为______,反应④的化学方程式为______。
(5)反应④中,D断裂的化学键是_______ (填“C一H”、“O一H”或“C一O”)
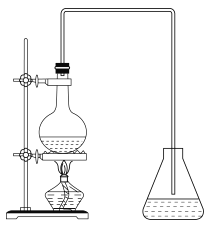
(6)实验室由反应④制备E的装置如图所示。烧瓶中依次加入C、浓硫酸、D和碎瓷片,锥形瓶中加入的是饱和碳酸钠溶液,实验结束后振荡锥形瓶内液体,看到有气泡产生,产生气泡的原因是__________(用离子方程式表示),将锥形瓶中的液体分离的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应H2(g)+I2(g)![]() 2HI(g)在温度和容积不变的条件下进行。能说明反应达到平衡状态的叙述是( )
2HI(g)在温度和容积不变的条件下进行。能说明反应达到平衡状态的叙述是( )
A. c(H2)=c(I2) B. H2的消耗速率等于HI的分解速率
C. 容器内气体的颜色不再变化 D. 容器内压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铑基催化剂催化CO加氢合成甲醇(CH3OH)、乙醛(CH3CHO)、乙醇等碳的含氧化合物是近年来化学界比较活跃的研究课题之一。
(1)已知:(ⅰ)CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol
CH3OH(g) △H1=-90.1kJ/mol
(ⅱ)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5kJ/mol
CH3OCH3(g)+H2O(g) △H2=-24.5kJ/mol
(ⅲ)C2H5OH(g)![]() CH3OCH3(g) △H3=+50.7kJ/mol
CH3OCH3(g) △H3=+50.7kJ/mol
则由CO催化加氢制备乙醇气体(另一产物为水蒸汽)的热化学反应方程式为________。
(2)直接甲醇燃料电池(DMFC)成本低、效率高,某研究所尝试用DMFC电解处理含氰电镀废水。调节废水pHl0~12.5,电解过程中,CNˉ先被氧化成CNOˉ(两种离子中氮元素均为-3价),再进一步氧化为碳酸盐和N2。
①请写出CNOˉ被氧化的电极反应式________。
②欲处理1m3CNˉ含量为390mg/L的电镀废水,至少需准备________kg甲醇。
(3)在2.0L密闭容器中放入1 molCO与2molH2,在反应温度T1时进行如下反应:
CO(g)+2H2(g)=CH3OH(g),反应时间(t)与容器内气体总物质的量(n)的数据见下表:
时间t/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
总物质的量n/mol | 3.0 | 2.7 | 2.5 | 2.3 | 2.1 | 2.0 | 2.0 |
①在0~5min时段,反应速率v(CH3OH)为________;有利于提高上述反应平衡转化率的条件是________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
②计算温度T1时反应的平衡常数K1________;T1时达平衡后,改变反应温度为T2,平衡常数增大,则T2________T1(填“大于”“小于”),判断理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贵州的矿产资源丰富,在全国占优势地位的有铝、磷、煤、锰、重晶石、黄金、铅锌、锑等众多品种。回答下列问题:
(1)金元素属于铜族元素,原子结构与铜相似,在元素周期表中位于第六周期,基态金原子的外围电子排布图为__________;Cu2+能与多种离子或分子形成稳定性不同的配合物。经X射线衍射测得配合物酞菁铜的晶体结构,其局部结构如图所示:
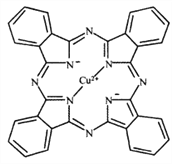
①酞菁铜结构中非金属元素电负性由大到小的顺序为__________;
②酞菁铜结构中N原子的轨道杂化类型为__________。酞菁铜结构中不存在的化学键类型为__________
A.配位键 B.金属键 C.σ键 D.π键
(2)煤通过干馏、气化、液化可获得清洁燃料和多种化工原料,氨是其中之一。NH3的 VSEPR模型为__________。
(3)锰、铁两元素中第三电离能较大的是__________(填元素符号),原因是___________。
(4)碲化锌(ZnTe)具有宽禁带的特性,常用于制作半导体材料,碲化锌晶体有立方和六方两种晶型,其立方晶胞结构如下图所示。
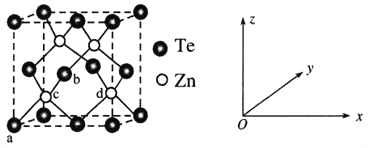
①原子坐标参数表示晶胞内部各原子的相对位置。已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() )。则d的原子坐标参数为__________。
)。则d的原子坐标参数为__________。
②若两个距离最近的Te原子间距离为apm,则晶体密度为__________g/cm3(列式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合H+ + OH-=H2O离子反应的是( )
A.稀硫酸与稀氨水B.稀硫酸与氢氧化钡溶液
C.稀硝酸与氢氧化钡溶液D.盐酸与氢氧化铁反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与盐类的水解无关的是
A. 明矾用于净水
B. 次氯酸钠常用作消毒剂
C. FeCl3溶液滴入沸水中制Fe(OH)3胶体
D. 用碳酸氢钠和硫酸铝两种溶液可制成泡沫灭火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如右图,该电池工作时反应为4VB2+ 11O2=4B2O3+2V2O5。下列说法正确的是
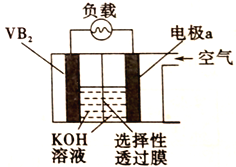
A. VB2极为负极,发生还原反应 B. 图中选择性透过膜只能让阳离子选择性透过
C. 电子由VB2极经导线、负载流向电极a D. 电极a上发生反应为O2+2H2O-4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com