
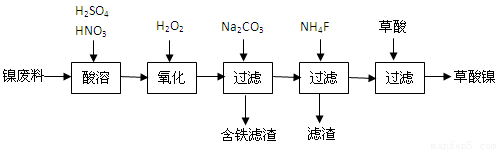
(14��)������������һ����Ҫ�ĵ���Ԫ�����ϡ����ز��ϡ���ҵ�����ú������ϣ�������þ�Ͻ�Ϊ������ȡ���������ٸ������ղ�������ȡ��������������֪����ĸơ�þ������������ˮ���������й�������ʾ��ͼ�ش����⡣
(1)���������ж�ν��й��ˡ�ʵ���ҽ��й��˲������õ����������������������� ��
(2)������������������̼������Һ��pH��4.0~4.5���ң�����̼������Һ�������� ���ټ���NH4F��Ŀ���� ��
(3)��������NiC2O4��2H2O�����ȿ����и�����ˮ���ڸ�����������Сʱ���Ƶ�������������ͬʱ���һ�ֻ�����塣д�����������ȷֽ�Ļ�ѧ����ʽ ��
(4)��ҵ�ϻ����õ�ⷨ��ȡ��������������NaOH��Һ����NiCl2��ҺpH��7.5���������������ƺ���ö��Ե缫���е�⡣�������в�����Cl2��80%������������������ClO�����ٰѶ���������Ϊ��������д��ClO������Ni(OH)2�������������������ӷ���ʽ ��a mol������ȫ��ת��Ϊ������ʱ�����·��ͨ�����ӵ����ʵ����� ��
(5)��ⷨ��ȡ����������ʵ�ʹ����У���ʱ���һ�ֽᾧˮ�����֪1mol�������к���0.5 mol�ᾧˮ��ȡ�û�����20.2 g���г�ּ��ȣ���������������������0.2 molˮ����ýᾧˮ����Ļ�ѧʽΪ ��
��1������ (2)����pH���ٽ�������ˮ�������ȫ ��ȥ�����ӡ�þ����
(3)2NiC2O4 ![]() Ni2O3+3CO��+CO2�� (4)ClO-+2Ni(OH)2==Cl-+Ni2O3+2H2O 1.25a mol
Ni2O3+3CO��+CO2�� (4)ClO-+2Ni(OH)2==Cl-+Ni2O3+2H2O 1.25a mol
(5)NiOOH��1/2H2O ��2 NiOOH��H2O
����:��1���ڹ��˲����в����������������������ǽ��裻
��2��������ͼ�������ܡ����ɺ����������ơ�þ���ӵ���Һ����˫��ˮ��Ŀ������������Fe3+������̼������Һ�������ǵ���pH���ٽ�������ˮ�������ȫ���ټ���NH4F��Ŀ���dz�ȥ�����ӡ�þ���ӣ������Ӳ���ʱ���ɲ�����������
��3����������NiC2O4��2H2O�����ȿ����и�����ˮ������NiC2O4��NiC2O4�ٷ���������ԭ��Ӧ��Ni��+2�����ߵ�+3�ۣ���C��+3�۽��͵�+2�ۣ�����Ҫ�����ɻ�����壬����һ����ΪCO2������Ni2O3��CO��CO2�������û��ϼ����������ƽ����ʽΪ��
2NiC2O4![]() Ni2O3+3CO��+CO2��[Ni������2��(3-2)��C: ����1��(4-3)��C:���ͣ�3��(3-2)]
Ni2O3+3CO��+CO2��[Ni������2��(3-2)��C: ����1��(4-3)��C:���ͣ�3��(3-2)]
��4��ClO-+2Ni(OH)2==Cl-+Ni2O3+2H2O��Cl��+1�۽��͵�-1�ۣ�Ni��+2�����ߵ�+3�ۣ����û��ϼ�������ȿ���ƽClO-��Ni(OH)2��Cl-��Ni2O3��ϵ����������Hԭ���غ���ƽˮ��ϵ������������Oԭ�Ӽ����ƽ�Ƿ���ȷ����
ClO-+2Ni(OH)2==Cl-+Ni2O3+2H2O
1 2
n(ClO-) a mol ��n(ClO-)=0.5 a mol
Cl2+2OH-= ClO-+ Cl-+H2O
0.8n(Cl2) 0.5 a mol ��n(Cl2)=0.625 a mol
���е��ʱ��2Cl--2e-=Cl2��
2 1
n(e-) 0.625 a mol ��n(e-)=1.25a mol��
��5��0.2 molˮ������Ϊ3.6g����m(Ni2O3)= 20.2 g -3.6g=16.6g��n(Ni2O3)=0.1mol
����n(Ni2O3)��n(H2O)= 0.1mol: 0.2 mol=1:2��������ԭ���غ�д�ɽᾧˮ�������ʽ��
��1mol�������к���0.5 mol�ᾧˮ������NiOOH��1/2H2O�����ϳɣ�2NiOOH��H2O



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2012�콭��ʡ��ͨ��ͨ��������4�²�©��ȱר���⻯ѧ�Ծ����������� ���ͣ������
(14��)������������һ����Ҫ�ĵ���Ԫ�����ϡ����ز��ϡ���ҵ�����ú������ϣ�������þ�Ͻ�Ϊ������ȡ���������ٸ������ղ�������ȡ��������������֪����ĸơ�þ������������ˮ���������й�������ʾ��ͼ�ش����⡣
(1)���������ж�ν��й��ˡ�ʵ���ҽ��й��˲������õ����������������������� ��
(2)������������������̼������Һ��pH��4.0~4.5���ң�����̼������Һ�������� ���ټ���NH4F��Ŀ���� ��
(3)��������NiC2O4��2H2O�����ȿ����и�����ˮ���ڸ�����������Сʱ���Ƶ�������������ͬʱ���һ�ֻ�����塣д�����������ȷֽ�Ļ�ѧ����ʽ ��
(4)��ҵ�ϻ����õ�ⷨ��ȡ��������������NaOH��Һ����NiCl2��ҺpH��7.5���������������ƺ���ö��Ե缫���е�⡣�������в�����Cl2��80%������������������ClO�����ٰѶ���������Ϊ��������д��ClO������Ni(OH)2�������������������ӷ���ʽ ��a mol������ȫ��ת��Ϊ������ʱ�����·��ͨ�����ӵ����ʵ����� ��
(5)��ⷨ��ȡ����������ʵ�ʹ����У���ʱ���һ�ֽᾧˮ�����֪1mol�������к���0.5 mol�ᾧˮ��ȡ�û�����20.2 g���г�ּ��ȣ���������������������0.2 molˮ����ýᾧˮ����Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ��ͨ��ͨ��������4�²�©��ȱר���⻯ѧ�Ծ��������棩 ���ͣ������
(14��)������������һ����Ҫ�ĵ���Ԫ�����ϡ����ز��ϡ���ҵ�����ú������ϣ�������þ�Ͻ�Ϊ������ȡ���������ٸ������ղ�������ȡ��������������֪����ĸơ�þ������������ˮ���������й�������ʾ��ͼ�ش����⡣
(1)���������ж�ν��й��ˡ�ʵ���ҽ��й��˲������õ����������������������� ��
(2)������������������̼������Һ��pH��4.0~4.5���ң�����̼������Һ�������� ���ټ���NH4F��Ŀ���� ��
(3)��������NiC2O4��2H2O�����ȿ����и�����ˮ���ڸ�����������Сʱ���Ƶ�������������ͬʱ���һ�ֻ�����塣д�����������ȷֽ�Ļ�ѧ����ʽ ��
(4)��ҵ�ϻ����õ�ⷨ��ȡ��������������NaOH��Һ����NiCl2��ҺpH��7.5���������������ƺ���ö��Ե缫���е�⡣�������в�����Cl2��80%������������������ClO�����ٰѶ���������Ϊ��������д��ClO������Ni(OH)2�������������������ӷ���ʽ ��a mol������ȫ��ת��Ϊ������ʱ�����·��ͨ�����ӵ����ʵ����� ��
(5)��ⷨ��ȡ����������ʵ�ʹ����У���ʱ���һ�ֽᾧˮ�����֪1mol�������к���0.5 mol�ᾧˮ��ȡ�û�����20.2 g���г�ּ��ȣ���������������������0.2 molˮ����ýᾧˮ����Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com