
| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | 元素周期表第ⅠA族元素都是金属元素 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
分析 A.互为同位素原子的化学性质几乎完全相同;
B.第ⅠA族元素氢是非金属;
C.电子层结构相同,核电荷数越大离子半径越小;
D.同主族元素最高价含氧酸自上而下酸性减弱;
解答 解:A.3517Cl与3717Cl互为同位素,化学性质几乎完全相同,电子能力相同,故A正确;
B.第ⅠA族元素氢是非金属,故B错误;
C.S2-、Cl-、Ca2+、K+电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl->K+>Ca2+,故C错误;
D.同主族元素最高价含氧酸自上而下酸性减弱,不是最高价含氧酸不一定,如HClO为弱酸、HBrO4为强酸,故D错误;
故选A.
点评 本题考查同主族元素性质递变规律、微粒半径比较、原子结构与性质关系等,难度不大,注意对基础知识的理解掌握.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
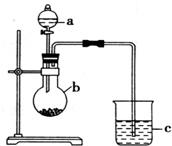 “元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答:
“元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ①②⑥ | C. | ②③④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性X-强于Y2- | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质X2能将Y的阴离子Y2-氧化,并发生置换反应 | |
| D. | X的氢化物比Y的氢化物沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与氢氧化钠溶液 | B. | 氯化氢溶于水 | ||
| C. | 氯化氢与氨反应 | D. | 锌与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com