

(1)0—t1速率变化的原因是______________________________。
(2)t1—t2速率变化的原因是______________________________。
解析:此题考查酸和金属反应的实质、特点(放热),以及综合考虑浓度、温度对化学反应速率的影响,从而对影响反应速率的时间变化曲线图象,提出合理的解释。
Zn与稀H2SO4反应产生H2的离子方程式为Zn+2H+![]() Zn2++H2↑,最初c(H+)大,反应速率较快,由于Zn与稀硫酸反应为放热反应,随反应进行,温度升高,而c(H+)没有明显降低,故反应速率加快;故t1之前v(H2)逐渐增大;t1之后,c(H+)明显降低,反应速率降低,故v(H2)又逐渐减小。
Zn2++H2↑,最初c(H+)大,反应速率较快,由于Zn与稀硫酸反应为放热反应,随反应进行,温度升高,而c(H+)没有明显降低,故反应速率加快;故t1之前v(H2)逐渐增大;t1之后,c(H+)明显降低,反应速率降低,故v(H2)又逐渐减小。
答案:(1)Zn与稀H2SO4反应为放热反应,随反应进行,温度升高,c(H+)减小,但温度升高是主要因素,所以反应速率加快
(2)虽然反应继续放热,但c(H+)降低是主要因素,所以反应速率降低


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:设计必修二化学苏教版 苏教版 题型:022
下图所示为将Zn投入一定浓度一定体积的H2SO4溶液中,解释图象的成因(纵坐标为H2的生成速率).
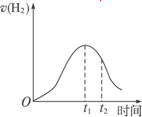
(1)0-t1速率变化的原因是________.
(2)t1-t2速率变化的原因是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com